آناتومیک در ساخت ایمپلنت مخصوص بیمار و ابزار جراحیِ ترمیمی با بالاترین کیفیت تخصص دارد. این سیستم تحت یک سیستم کنترل کیفیت مستقل که دارای گواهینامه استاندارد ISO 13485، استاندارد بین المللی سیستم مدیریت کیفیت (QMS) برای طراحی و ساخت دستگاههای پزشکی است، فعالیت می کند. در حال حاضر آناتومیک پیشرو بازار در فناوریهای مخصوص بیمار است. این شرکت یک شبکه جهانی فروش کالا را اجرا میکند و به عنوان یک تولید کننده تجهیزات اصلی برای شرکتهای بزرگ دستگاههای دارویی فعالیت می کند.
اخیراً، آناتومیک ایمپلنتهای جدید تیتانیومی با چاپ سه بعدی و ایمپلنتهای کامپوزیت پیشرفتهی تیتانیوم/ پلیمر متخلخل را با ارتباط با بدنهی تحقیق برتر استرالیا، سازمان تحقیقات علمی و صنعتی مشترک المنافع (CSIRO) و مرکز تولید پیشرفته دانشگاه RMIT توسعه داده است. آناتومیک یک برنامه تحقیق و توسعه جامع را در زمینه ایمپلنتهای ارتوپدی پیشرفته، مواد و روشهای نوین کاشت، اکوسیستم های مراقبتهای بهداشتی شخصی و ایمپلنتهای جراحی مغز و اعصاب ضد سرطانی ادامه می دهد.
3-2-2 ایمپلنتهای تیتانیومی با چاپ 3 بعدی- تحقیقات انتخابی
3-2-2-1 ایمپلنت کلکانوس (پاشنه)- تحقیقی از پروفسور پیتر چونگ، بیمارستان خیابان وینسنت، ملبورن، استرالیا
یک مرد 71 ساله که از درد مزمن در استخوان پاشنه ی راست برخوردار بوده، به جراح ارتوپدی خود مراجعه کرده است. سی تی اسکن یک ضایعه مخرب را که با نمونهبرداری تأیید شده است نشان داد که یک کندوسارکوم، یک سرطان بدخیم استخوان با منشاء غضروف است. یک درمان استاندارد برای این بیماری بالاتر از قطع عضو مچ پا است زیرا هیچ کاشت استاندارد قفسه (OTS) در دسترس نیست. برای جلوگیری از قطع عضو، جراح تصمیم گرفت که یک طرح ایمپلنت مخصوص بیمار با آناتومیک طراحی کند.
برشهای سی تی اسکن با وضوح بالا به آناتومیک ارسال شده و یک سطح آمادهشدهی سه بعدی انجام شد. همچنین، طرف دگرگون نشدهی مقابل نیز "آینه شده" تا شکل کلی پاشنهی پا را به صورت هدفمند ترمیم کند. یک "اسکلت" یا چارچوب ایمپلنت با استفاده از نرم افزار CAD طراحی شد. بایومدل پلاستیک جداگانه از شکل و چارچوب هدف کلی، پرینت سه بعدی شد. این موارد به جراح ارائه شد که سپس تغییرات طراحی بعدی را نوشت. نقاط لنگر بخیه ایجاد شد تا امکان ایجاد بخیه تاندون ها، رباط ها و سایر بافت نرم فراهم شود در حالی که سطوح برای پولیش براق مشخص میشدند. جراح برای کاهش وزن و ایجاد پیوستگی بافت، شبکه مشبندی شده در سراسر بدنهی ایمپلنت درخواست کرد. این تغییرات سپس در CAD پیاده سازی شدند و پس از تأیید طراحی از جراح، فایل STL برای چاپ سه بعدی ارسال شد. فایلها برای چاپ با سیستم ذوب پرتوهای الکترونیکی آرکام A1 (EBM) به آزمایشگاه CSIRO 22 در کلیتون، استرالیا ارسال شدند. سپس این قطعه جهت پرداخت پایانی برای تولید ایمپلنت نهایی به آناتومیک برگردانده شد. این قطعه کنترل کیفیت شد تا تأیید شود با پرونده STL مطابقت دارد، انتخابی پولیش شد، تمیز شد، بستهبندی شد، به عنوان یک وسیله پزشکی قابل کاشت برچسب گذاری شد و به بیمارستان تحویل داده شد. سطوح مفصل و نقاط لنگر بخیه بسیار جلا داده شده و بدنه ایمپلنت تا انتهای مات جلا داده شده است. ایمپلنت نهایی 54×86×59 میلی متر اندازه گیری شد.
جراحی در ژوئیه 2014 رخ داده است. جراح کل استخوان پاشنه را جدا کرده و ایمپلنت را در نقص ناشی از آن قرار داد. جراحان گزارش دادند که پروتز کاملاً در نقص قرار گرفته و قبل از اتصال به بافت نرم پایدار بوده است. ایمپلنت به بافت نرم، رباط ها و تاندون آشیل اطراف آن بخیه داده شد. بهبودی بعد از عمل با عدم تحمل وزن به مدت شش هفته، بدون اختلال گزارش شد. پنج ماه بعد از عمل، بیمار توانست بدون درد، روی پاهای برهنه راه برود [20] (شکل 3-2-1).

شکل 3-2-1 ایمپلنت تیتانیوم نهایی، قطعهی پرداخت نشده، نمونه اولیه پلاستیک
3-2-2-2 ایمپلنت جناغ سینه و دنده ها (نسخه یک)- تحقیقی از دکتر جوزه آندرا، بیمارستان دانشگاه سالامانکا، سالامانکا، اسپانیا
یک جراح قفسه سینه اسپانیایی در مورد بیمار مبتلا به سرطان سینه با آناتومیک ارتباط برقرار کرد. بیمار یک مرد 54 ساله بود که با زائده 8 سانتی متری در قفسه سینه حاضر شد. سی تی اسکن ضایعهای را نشان داد که نه تنها قفسه سینه بلکه هر دو عضلهی قفسه سینه و دندههای مجاور را درگیر میکرد. ظاهر ضایعه با کندوسارکوم سازگار بود، که نیاز به جراحی برداشتن داشت. جراح طرحی برای برداشتن تومور و ترمیم نقص به وجود آمده با یک سازه جایگزین جناغ سینه و دنده در یک عمل جراحی، به آناتومیک ارائه کرد. آناتومیک توصیه کرد که می تواند یک الگوی برش استخوان پرینتسهبعدیشده (BRT) به همراه ایمپلنت ایجاد کند تا بتواند خط برش برنامه ریزی شدهی تومور را در حین عمل به بیمار منتقل کند.
طرح های اولیه بصورت الکترونیکی به جراح ارائه شد. این طرح هم شامل شکل ایمپلنت و هم BRT بود. ایمپلنت به گونهای طراحی شده بود که شامل بدنی با ابعاد مشابه قفسه سینهی برداشته شده و میلههای تیتانیوم به عنوان دندههای جدید با بست برای اتصال به هر دنده باشد. بدنه ایمپلنت دارای سوراخهای کور در جلو بود تا باعث کاهش وزن شود اما ایمپلنت یکنواخت و صاف از پشت باشد. BRT برای قرار دادن در قفسه سینه در شکاف جناغ سینه، قسمت بالایی سینه و روی هر دنده در محل برداشته شده، طراحی شده است. این به جراح اجازه می دهد تا مرزهای برداشت شده برنامه ریزی شده در امتداد لبه BRT را ردیابی کند.
ورودیهای طراحی جراح ذکر شد و برای توسعه بیشتر، همکاری آماده شد. برنامه های تعاملی آنلاین "AnatomicsC3D" بین مهندسان آناتومیک در استرالیا و تیم جراحی اسپانیا انجام شد. از ویژگیهای بحرانی طراحی، گیرههای فیکسکننده دنده بود که نیاز به نشان دادن عملکرد بهتر نسبت به صفحه و سیستم های فیکسچر موجود بود زیرا مستعد شل شدن در استخوان نازک انتهای دنده بود. برای این منظور، گیره ها با اندازه و شکل تکه های دنده مطابقت داشتند و سطح داخلی "دندانی شکل" را برای گیرندهی غضروف دنده در نظر گرفتند. قرار بود قلاب های دنده با پیچ های تیتانیومی با طول سفارشی از طریق سوراخ های کور پیش ساخته در هر گیره قفل شوند.
پس از مدل سازی کامپیوتری، نمونه های اولیه فیزیکی از جنس پلاستیک و تیتانیوم توسط آناتومیک چاپ و مورد آزمایش قرار گرفت تا تأیید شود که گیره های فیکس کننده دنده مطابق نیاز عمل میکند. طرحهای کلی گیره در طی این فرآیند پالایش بیشتری شد و به هر دنده همسان شد.
هنگامی که طرح های نهایی ایمپلنت و BRT توسط جراح مورد تأیید قرار گرفت، فایلهای CAD بهینه سازی شد و به فرمت STL برای پرینت سه بعدی تبدیل شدند. BRT در آناتومیک با استفاده از فرایند لایه ذوبی پرینت شد و ایمپلنت در آزمایشگاه CSIRO 22 در سیستم Arcam A1 EBM پرینت شد. این قسمت برای اطمینان از کیفیت، اتمام، پرداخت، تمیز کردن و بسته بندی به آناتومیک برگردانده شد. سپس ایمپلنت و BRT برای کاشت به اسپانیا فرستاده شدند. ایمپلنت 190×77×133 میلی متر اندازه گیری شد.
عمل جراحی در سپتامبر 2014 انجام شد و با برداشتن بافت بزرگ سینه از قسمت جلو آغاز شد، در مرزی که توسط BRT عرضه شده مشخص شده بود. تومور "یک پارچه" با پوست، ماهیچههای سینه، بدنهی جناغ و غضروف طبق مرز مشخص شده توسط BRT برداشته شد. قطعهی بزرگ مواد سنتز شده قبل از جایگذاری در قسمت پشتی ایمپلنت ثابت شد. نقص بافت نرم با لایهی عضلانی عروقی پوشانده شد. بیمار بعد از عمل به خوبی بهبود یافت و 12 روز بعد از عمل با نتایج عالی اشعه X قفسه سینه، مرخص شد [21] (شکل 3-2-2).

شکل 3-2-2 ایمپلنت جناغ سینه / دنده و برش الگو
3-2-2-3 ایمپلنت جناغ سینه و دندهها (نسخه دو)- تحقیقی از دکتر پاول پیترز بیمارستان خصوصی گرینسلوپس، بریزبن، استرالیا
با مشاهده نتیجه پرونده بازسازی جناغ سینه اسپانیایی، یک جراح قلب و عروق مستقر در بریزبن، استرالیا، یک دستگاه مشابه را برای بیماری با تومور سلولی میکروبی میانسینهای نفوذ کرده در ناحیهی جناغ سینه، درخواست کرد. جراح می خواست بدنه ی جناغ سینه را برش دهد در حالی که قسمت بالا و پایین را رها کند تا از پایداری قفسه سینه قدامی اطمینان حاصل شود. این کاشت قرار بود شامل سه مجموعه دنده در مقایسه با چهار مجموعه برای مورد اصلی اسپانیایی باشد.
برای تسهیل درج ایمپلنت و اتصال به قفس دنده، پیشرفتهایی در گیره های ثابت کننده غضروف دنده انجام شد. دهانه گیره اصلاح شد تا جاسازی دنده ها به جای انتها، بتواند از زیر گیره صورت بگیرد تا نیاز به گسترش قفسه سینه هنگام جاسازی ایمپلنت از بین برود. بدنه ایمپلنت برای کاهش بیشتر وزن و مواد از طرح اصلی و افزایش تخلخل مشبک شده است. لبه بالایی بدنهی ایمپلنت برای حفظ کامل مفاصل جناغ/دندهی اول در هر دو طرف و به حداکثر رساندن سطح مشترک استخوان/ایمپلنت انحنا داده شد. اجزای دنده ایمپلنت از میله به تسمههایی با تقریبا 5 میلی متر عرض و 2 میلی متر ضخامت تغییر یافت. BRT ای که به شکاف و خط فاصل جناغ متصل شده است و مطابق با سینهی جلویی است برای هدایت مرز برش طبق مورد اسپانیایی ساخته شد. ایمپلنت نهایی 189×48×113 میلی متر اندازه گیری شد. جراحی در ماه مه 2016 انجام شد و جراح از عمل جراحی بدون اتفاق و نتیجهی بعد از عملِ خوب و بهبودی بیمار گزارش داد (شکل 3-2-3).

شکل 3-2-3 قطعه "چاپ سه بعدی شده" و ایمپلنت نهایی.
3-2-2-4 ایمپلنت جناغ سینه و دندهها (نسخه سه)- تحقیقی از دکتر ایهاب بیشِی، بیمارستان هرتلندز، بیرمنگام، انگلستان
یک جراح قلب و عروق در انگلستان در مورد بیماری که جزئی از جناغ سینهاش را به دلیل یک عفونت غیرمعمول از دست داده است و نیاز به جراحیِ برداشتن به روش قبلی داشت، با آناتومی تماس گرفت. این کاشت به بدنهی کمتری نسبت به نسخه های قبلی و تنها دو جفت دنده احتیاج داشت. آناتومیک راه حل جدیدی را برای کاهش وزن کاشت پیشنهاد کرد در حالی که حجم، شکل و بافت به صورت یکپارچه آماده شود. آناتومیک ایمپلنتی کامپوزیتی با یک قالب تیتانیوم و پوشش پلیاتیلن متخلخل اختصاصیاش PoreStar که اجزای بدنه و دنده را پوشانده است، ساخت. PoreStar یک ماده کاشت دائمی است که توسط آناتومیک توسعه یافته است و متشکل از یک شبکه متخلخل همه کاره از میکرو ذرات به شکل ستارهی سه پره از پلی اتیلن با چگالی بالا است، که به هم پیوند میخورند تا ساختاری با بیش از 50٪ تخلخل، با حفظ استحکام مکانیکی بالا ایجاد کند. این مادهی ایمپلنت به طور معمول توسط آناتومی برای ایجاد ایمپلنت متخلخل برای بازسازی جمجمهی صورت و جراحی تقویت مغز و اعصاب، جراحی فک و صورت و جراحی پلاستیک استفاده می شود. با این حال، این مورد اولین بار در جهان است که چنین ایمپلنت کامپوزیت چاپ 3 بعدی شده تیتانیوم / پلیمر متخلخل ساخته و کاشته شده است. پوشش PoreStar امکان سبکی و پیشرفت ساختاری را فراهم می کند. ایمپلنت نهایی 181×70×87 میلی متر اندازه گیری شد.
عمل جراحی در سپتامبر 2016 انجام شد. کاشت طبق برنامه ریزی انجام شد؛ با این حال جراح گزارش داد که برای تطبیق بهتر ایمپلنت، باید انتهای تمام دندهها را اندکی تراشید. تثبیت ایمپلنت به انتهای دندهها با پیچ های تیتانیومی تهیه شده در گیرههای دندهها به دست آمد. بعد از عمل، بیمار بهبود پیدا کرد و از توانایی تنفس و اعتماد به نفس در انجام فعالیتهای روزانه گزارش شد. بهبود عملکرد ریه از طریق تصویربرداری فیزیولوژیکی اندازهگیری شد که بهبود قابل توجهی نسبت به وضعیت قبل از عمل بیمار را تأیید کرد (شکل 3-2-4).

شکل 3-2-4 کامپوزیت PoreStar/ ایمپلنت تیتانیوم چاپ سه بعدی شده.
3-2-2-5 ایمپلنت اتصال ستون فقرات گردن پشتی- تحقیقی از دکتر پل د اوسو، بیمارستان اپوورث، ملبورن، استرالیا
بیمار پیرزن 64 ساله ای که به دلیل فشردهشدن ریشه عصب، ناشی از تحلیل ستون فقرات گردن، از درد گردن و بازو رنج میبرد، با دریافت نوع جدیدی از ایمپلنت با حداقل تهاجم به عنوان گزینه ای برای درمان جراحی سنتی موافقت کرد، که به طور معمول نیاز به اتصال در مقیاس بزرگ از پشت جمجمه تا پشت گردن با استفاده از چندین مؤلفه ثابت کنندهی به هم چسبیده دارد. ایده جراح شامل ساختاری کوچک است که می تواند از طریق برش کوچک بین قوس پشتی دو مهره فوقانی گردن وارد شود تا با جابجایی اندک استخوانها، فشار را روی اعصاب نخاعی تسکین دهد. این وسیله پیچ های تثبیت کنندهی با طول مورد نیاز برای اتصال مهره ها را در خود جای داده و توسط یک راهنمای ساده مته چاپ سه بعدی شده هدایت میشود که در جراحی با پشت مهره C2 همتراز میشود. سرانجام، وسیلهی ایمپلنت شده با پیچ های کوچک در قسمت پشتی مهرههای فوقانی گردن به طور دائمی متصل می شود.
جراح مفهوم ایدهی اولیه را از طریق یک سری طرح به آناتومیک ارائه داد. آناتومیک از این طرح های مرتبط با سی تی اسکن با وضوح بالای بیمار استفاده کرد تا اولین طرح پیش نویس ایمپلنت و متهی راهنما را بسازد که پس از آن به صورت الکترونیکی به جراح ارائه شد. طرح شامل هدف مطلوب، جابجایی آناتومیکی مهره ها بعد از جایگیری ایمپلنت بود. پس از توسعهی بیشتر طرح، جراح به صورت تعاملی با مهندسان آناتومیک طرح ایمپلنت، جابجایی استخوانِ هدف مربوطه، طول پیچها و مسیرها را تأیید کرد.
ماکتهای فیزیکی بایومدل از ستون فقرات موجود، آناتومی هدف، ایمپلنت و متهی راهنما تولید شد و برای تایید نهایی و گرفتن رضایت آگاهانه از بیمار، به جراح ارسال شد.
سپس بخش تیتینانیومی با تبدیل کردن بخش به یک دستگاه ایمپلنتکنندهی پزشکی پرینت میشود. پیچ متهی راهنما از جنس پلاستیک زیستسازگار، با استفاده از مدل رسوبنشانی ذوبی چاپ شد و به همراه ایمپلنت و بایومدلهای آناتومیک به بیمارستان ارسال شد. ایمپلنت 42×42×35 میلی متر اندازه گیری شد.
جراحی در فوریه سال 2016 انجامشد. عمل به راحتی با جایگیری ایمپلنت انجام شد و متهی راهنما اجازه داد سوراخهای راهنمای صحیح برای پیچ های بزرگ متصل کننده حفر شود. با اندکی تغییر در برنامه پیشدرمان، جراح تصمیم گرفت که فقط دو پیچ تثبیتکنندهی کوچک، به جای چهار تایی که در ابتدا برنامهریزی شده بود، برای محکم کردن ایمپلنت به پشت مهره های لازم است (شکل 3-2-5 و 3-2-6).
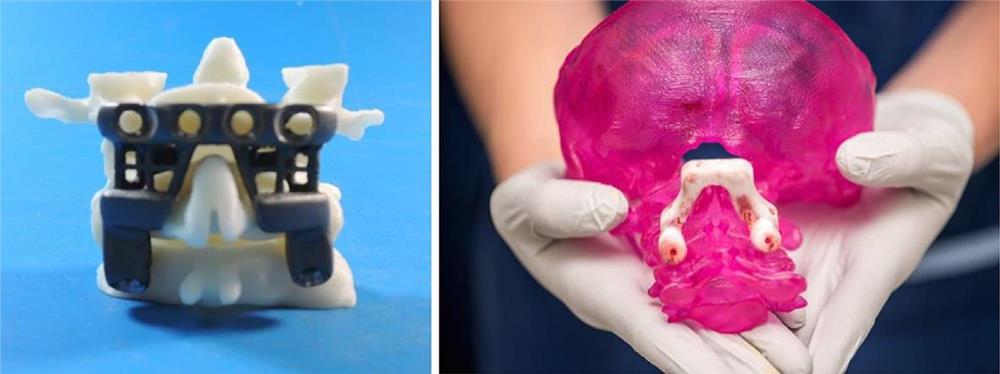
شکل 3-2-5 قفس متصلکننده پشتی ، بایومدل ها و متهی راهنما.
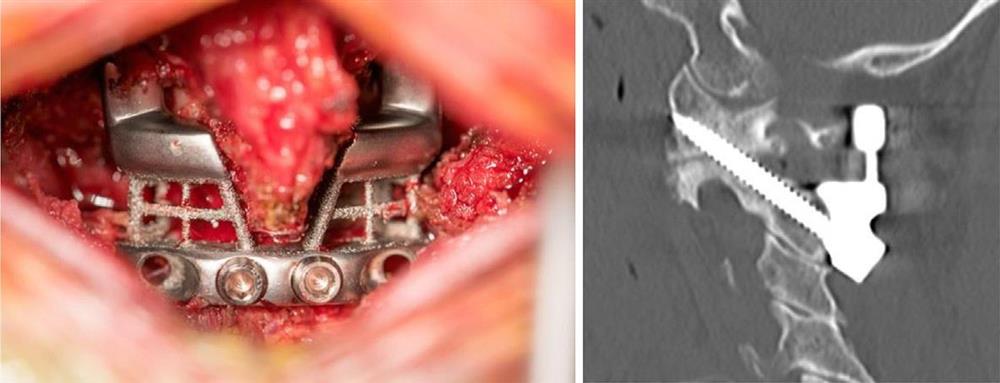
شکل 3-2-6 نمای داخلی ایمپلنت و سی تیِ بعد از عمل.
6-2-2-3 ایمپلنتهای بههم پیوستهی ستون فقرات- تحقیقی از دکتر رالف ج. موبز و دکتر مارک کوقلان، بیمارستان پرنس ولز، سیدنی، استرالیا
1-6-2-2-3 مورد اول
یک مرد 63 ساله با سه ماه سابقه درد گردن و شانه به جراح مغز و اعصاب خود (R.J.M.) مراجعه کرد. تصویربرداری یک آسیب مخرب را نشان داد که شامل بدنههای دو مهره بالایی گردن (C1 و C2) بود. نمونهبرداری از طریق دهان، تومور را به صورت کوردوما نشان داد، که در صورت عدم درمان منجر به درد شدید، فلج دست و پا و مرگ میشد. یک عمل اولیه با استفاده از ایمپلنتهای تجاری مرسوم، به منظور متصل کردن پشت جمجمه (استخوان پشت گردن) به ستون فقرات گردنی فوقانی انجام شد تا قبل از برداشتن تومور با روشهای قدیمی، به یک ثبات برسد. سپس تصویربرداری سیتی اسکن سه بعدی بعد از عمل برای دستیابی به طراحی ایمپلنت وبرنامهریزیهای جراحی انجام شد.
جراح به منظور برنامهریزی جراحی و جزئیات ایمپلت، با آناتومی مدلهای بیولوژیکی و تصویربرداریهای پزشکی کار میکرد. یک مدل منتخب رنگی که حضور ثابتسازی پیشین را برجسته میکند، ساخته شد و به جراح تحویل داده شد. رنگ قرمز پیچ ها همراه با نیمه شفافیت استخوان در مدل بیولوژیکی، محل ثابتسازی پیشین را تا برداشتن برنامهریزی شده تأیید کرد. طراحی بیشتر با استفاده از اندازهگیریهای از راه دور و الگوهای ایمپلنتی ادامه یافت. تثبیت ایمپلنت به قسمت جمجمه فوقانی و مهرههای پایین برداشتن (C3) با دو پیچ در هر موقعیت برنامه ریزی شده بود. مسیر و ابعاد پیچ از پیش تعیین شده بود و به جراح گزارش میشد.
طرح نهایی ایمپلت به عنوان ستونی با مشبندی ریز دو طرفه و یک مشبندی باز از جلو، برای پیوند استخوان تأیید شد. قسمت پشتی ایمپلنت به دلیل نزدیکی به نخاع، محکم و صاف بود. مابقی ایمپلنت برای اطمینان از داشتن یک سطح ناهموار به منظور ایجاد یکپارچگی استخوان، باید به صورت چاپ شده باقی بماند. برای کمک به محل قرارگیری پیچ، باید مسیرهای تثبیتسازی پیچ در دستگاه ساخته شود.
قسمت قفسه توسط آزمایشگاه CSIRO 22 در دستگاه Arcam A1 EBM چاپ شد و برای اطمینان از کیفیت، عملیات پردازش بعدی و آمادهسازی آن به عنوان یک ایمپلنت پزشکی به آناتومیک برگردانده شد. ابعاد ایمپلنت نهایی 20×36× 49 میلیمتر اندازهگیری شد. ایمپلنت بسته بندی شده با یک مدل بیولوژیکی رنگآمیزیشده انتخابی، از جمله برداشتن برنامهریزی شده و یک الگوی ایمپلنت پلاستیک و نشانههایی برای مسیر پیچ فولادی، به بیمارستان ارسال شد. مدل بیولوژیکی و الگوها استریله شدند و برای مسیرهای حین جراحی فراهم شدند.
عمل جراحی 5/16 ساعته در دسامبر 2016 انجام شد و با استفاده از روش عبوری دهانی ، جراح در حال شکافتن کف بینی بیمار برای دستیابی به تومور بود. مرزهای تومور که با کمک تصویربرداری حین جراحی تعیین میشدند؛ تومور به صورت توده برداشته شد. داربست طبق برنامه جراحی کاشته و تثبیت شد.
بعد از عمل، بیمار علیرغم برخی از اختلالات مفصل فک که به عمل طولانی مدت در وضعیت دهان باز نسبت داده شده، بهبود یافت. در پیگیری بعد از نه ماه، بیمار به طور عادی صحبت کرده و میبلعید و اشعه X عملکرد خوبی در کاشت کاشت نشان داد [22] (شکل 7-2-3).

شکل 7-2-3 قفس فیوژن BioModel و دهانه رحم قدامی انتخابی.
2-6-2-2-3 مورد دوم
یک زن 39 ساله به جراح مغز و اعصابش مراجعه کرد در حالی که به دلیل بیماری ستون فقرات کمر از درد شدیدی در باسن، کمر و پا رنج میبرد[22]. بیمار دچار ناهنجاری مادرزادی از پایینترین مهرهی کمری (L5) و از بین رفتن انحنای ستون فقرات و اختلال آن بود. نظر جراح این بود که نقص وی برای استفاده از گزینههای ایمپلنتهای استاندارد بسیار غیر معمول بوده و اینکه یک دستگاه اتصال کمر مخصوص بیمار، میتواند بهترین ترمیم و پشتیبانی را ارائه دهد.
جراح مغز و اعصاب دادههای سیتی اسکن سهبعدی بیمار را به همراه مشخصات طراحی اولیه خود به آناتومی ارسال کرد:
-
کاشت با استفاده از خطوط کروی که صفحات انتهایی بالا و پایین مهرهها را مطابق هم قرار میدهد.
-
برای دستیابی به حداکثر حجم پیوند استخوان، بدنهی ایمپلنت باید یک حلقه باریک باشد.
-
بدنهی ایمپلنت برای ایجاد حداکثر بافت در رشد و بهبود سازگاری تصویربرداری بعد از عمل، یک شبکه پراکنده باشد.
-
ایمپلنت برای افزایش انحنای ستون فقرات به شش درجه بود.
-
استحکام ایمپلنت برای تحمل وزن بدن بیمار و ضربههای جایسازی آن بایستی کافی باشد.
داربست با CAD طبق این مشخصات مدلسازی شد. با استفاده از آناتومی موجود، آناتومی با انحنای اصلاح شده و طراحی ایمپلنت کروی، ماکت های مدل بیولوژیکی تولید شد. همچنین به منظور دستیابی به محل جایگذاری ایمپلنت، یک آداپتور برای تقویت ابزار استاندارد جایسازی ایمپلنت طراحی شد.
قطعات داربست و آداپتور توسط مرکز تولید مواد افزودنی دانشگاه RMIT با استفاده از سیستم SLM Solutions SLM-250 چاپ شد و برای پردازش و اطمینان از کیفیت به استانداردهای دستگاه کاشت به آناتومیک برگردانده شد. ابعاد ایمپلنت نهایی 49×35×25 میلیمتر اندازهگیری شد.
این عملیات در مارس 2015 رخ داد و یک برنامه جراحی که شامل اتصال قدامی و پشتی بود، انجام شد. داربست ادغامی قبل از جایسازی، با استخوان پیوندی بسته بندی شده و با دقت زیادی در آن قرار گرفته بود. یک صفحه ثابتساز قدامی برای ایمنسازی دستگاه و پیچهای ثابت کننده اضافی برای ثابتسازی بیشتر در قسمت پشتی قرار داده شد.
در پیگیریهای بعد از 1 سال، در حالی که تصویربرداری یک اتصال جامد و عدم شکستن، جابهجایی یا فرونشستن ایمپلنت را نشان میداد، بیمار بهبود قابل توجهی در سطح درد خود گزارش داد[22] (شکل 8-2-3).
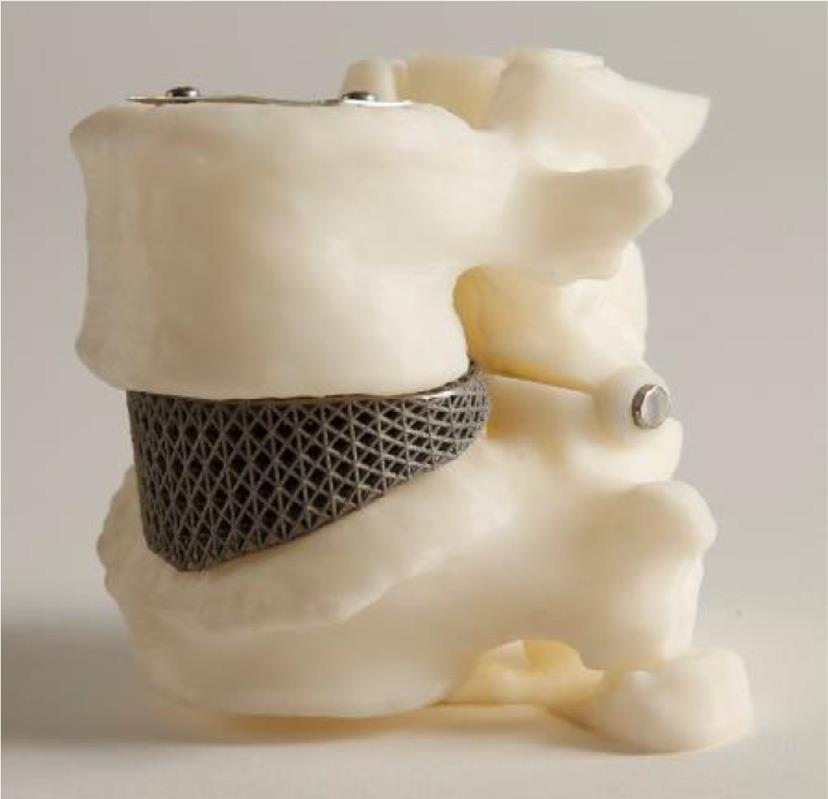
شکل 8-2-3 داربست ادغامی تیتانیوم و مدل بیولوژیکی.
7-2-2-3 ایمپلنت تعویض لگن - مطالعه موردی پروفسور آ. ایان وودگیت، بیمارستان خصوصی سیدنی شرقی، سیدنی، استرالیا
یک زن 17 ساله مبتلا به تومور بدخیم از کنارهی لگن خاصره که تحت پرتودرمانی قرار گرفته شد، باعث شد استخوان زنده به بعد از درمان نرسد. بازسازی منطقه با ایمپلنت های تجاری مرسوم نیز با شکستهشدن در محل، ناموفق بود، که باعث ایجاد نرمی و درد با شکستگیهای فاجعه باری شد که احتمالاً بیمار را ناتوان کرده است. جراح ارتوپدی وی سیتی اسکن با وضوح بالا را به آناتومیک منتقل کرد. سپس رندرهای سه بعدی از آناتومی و تثبیتسازی موجود را انجام داد تا جراح ایدههای طراحی و برنامه جراحی خود را برای از بین بردن استخوان آسیب دیده برنامهریزی کند. یک سازهی بزرگ لگن به منظور جایگزین کردن استخوان شکسته شده به همراه یک کاپ دقیق برای پذیرش کاپ سرامیکی تجاری دستگاه مفصل هیپ که در همان جراحی کاشته میشد، درخواست داده شد.
چندین مدل بیولوژیکی از آناتومی موجود و آناتومی مورد نظر، طراحی شدند و جلسات برنامهریزی آنلاین AnatomicsC3D برای تعیین موارد زیر انجام شد:
-
مورفولوژی دقیق کاشت.
-
محل و نوع بافتهای مختلف سطح (از درشت تا صاف).
-
پیکربندی جامد نسبت به اجزای شبکه.
-
نوع پیچهای تثبیتکننده (قفل کردن در مقابل پیچ های بدون قفل)، اندازه، موقعیت ها و بردارها.
-
حفرهها و حلقههای بخیه عضلانی.
-
جهتگیری و موقعیت کاپ هیپ.
پس از اتمام طراحی ایمپلنت، یک الگوی پلاستیکی ایمپلنت چاپ شد و بهمنظور تصویت طرح نهایی و جلب رضایت آگاهانه بیمار، به جراح ارسال شد.
بخش ایمپلنت توسط آزمایشگاه CSIRO 22 روی سیستم Arcam A1 EBM چاپ شد و برای اطمینان از کیفیت استاندارد و عملیات بعد از پردازش به آناتومی بازگردانده شد. سپس این قسمت با استفاده از ماشینکاری CNC به منظور افزودن رزوهها در سوراخ های پیچ انتخاب شده برای قفل کردن پیچ و آماده سازی دقیق قسمت مفصل هیپ برای درج سرامیکی که قرار بود در حین عمل در سازه قرار گیرد، پردازش شد. ابعاد ایمپلنت نهایی 80×134×150 میلیمتر اندازهگیری شد.
این عمل جراحی در ژوئن سال 2016 انجام شد و جراح گزارش داد که این عمل موفقیت آمیز بود. به طور خاص، پیچ های قفل و نواحی کاپ هیپ، همانگونه که نیاز بود عمل میکردند. سرامیک تجاری قرار داده شده به خوبی با کاپ هیپ فیت شده و اجازه دهد تا اجزای هیپ به خوبی با سرامیک قرار داده شده متصل گردد. جراح گزارش داد که بیمار بعد از عمل به خوبی بهبود یافت (شکل 9-2-3).

شکل 9-2-3 ایمپلنت لگن تیتانیوم و مدل بیولوژیکی.
3-2-3 نتیجه گیری
تخصص در طراحی آناتومیک و در دسترس بودن سیستمهای تولید افزایشی تیتانیوم، دستههای متنوعی از ایمپلنتهای جراحی صورت تا ایمپلنتهای ترمیمی در سراسر بدن فراهم کرده است. این ایمپلنتها از پایه جمجمه تا کف پا یا به عبارت دیگر از سر تا پا، استفاده میشوند. فرآیندهای سیستم کیفیت و مکانیزمهای کنترل طراحی که آناتومیک نظارت بر توسعه دستگاههای پزشکی که در جمجمه و صورت کار میکند، قادر میسازد تا دستگاه های منحصر به فرد قفسه سینه، ستون فقرات و ارتوپدی که نه تنها نیازهای منفرد کاربران را برآورده میکنند، بلکه اغلب از انتظارات نیز فراتر میرود، گسترش یابند.
در آینده نزدیک، مجمع مبتنی بر مراقبت های بهداشتی شخصی، جراحان را قادر می سازد تا وسایل خاص بیمار را برای بیماران خود تهیه کنند و برنامه های جراحی را برای استفاده از آنها در نقطه مراقبت های بالینی، یعنی در محیط بیمارستان، تنظیم کنند. در دسترس بودن فراگیر از چاپ سه بعدی و ساخت پیشرفته همراه با قابلیتهای طراحی دستگاه پزشکی آناتومی و راهحلهای زیست بومی جراحی، امکان اجرای بهترین روشهای جراحی و تکامل شیوههای بهتر به آینده را فراهم میآورد.
References:
[1] D’Urso, P.S., 1998, U.S. Patent No. 5,741,215, U.S. Patent and Trademark Office, Washington, DC.
[2] D’urso, P.S., 1998, U.S. Patent No. 5,752,962, U.S. Patent and Trademark Office, Washington, DC.
[3] D’Urso, P.S., 2000, U.S. Patent No. 6,112,109, U.S. Patent and Trademark Office, Washington, DC.
[4] P.S. D’Urso, D.J. Effeney, W.J. Earwaker, T.M. Barker, M.J. Redmond, R.G. Thompson, F.H. Tomlinson, Custom cranioplasty using stereolithography and acrylic, Br. J. Plast. Surg. 53 (3) (2000) 200–204.
[5] P.S. D’Urso, M.J. Redmond, A method for the resection of cranial tumours and skull reconstruction, Br. J. Neurosurg. 14 (6) (2000) 555–559.
[6] J.F. Arvier, T.M. Barker, Y.Y. Yau, P.S. D’Urso, R.L. Atkinson, G.R. McDermant, Maxillofacial biomodelling, Br. J. Oral Maxillofac. Surg. 32 (5) (1994) 276–283.
[7] P.S. D’Urso, R.L. Atkinson, I.J. Bruce, D.J. Effeney, M.W. Lanigan, W.J. Earwaker, R.G. Thompson, Stereolithographic (SL) biomodelling in craniofacial surgery, Br. J. Plast. Surg. 51 (7) (1998) 522–530.
[8] P.S. D’Urso, T.M. Barker, W.J. Earwaker, L.J. Bruce, R.L. Atkinson, M.W. Lanigan, D.J. Effeney, Stereolithographic biomodelling in cranio-maxillofacial surgery: a prospective trial, J. Cranio-Maxillofac. Surg. 27 (1) (1999) 30–37.
[9] P.S. D’Urso, R.G. Thompson, Fetal biomodelling, Aust. N. Z. J. Obstet. Gynaecol. 38 (2) (1998) 205–207.
[10] P.S. D’Urso, R.L. Atkinson, M.J. Weidmann, M.J. Redmond, B.I. Hall, W.J.S. Earwaker, D.J. Effeney, Biomodelling of skull base tumours, J. Clin. Neurosci. 6 (1) (1999) 31–35.
[11] P.S. D’Urso, B.I. Hall, R.L. Atkinson, M.J. Weidmann, M.J. Redmond, Biomodel-guided stereotaxy, Neurosurgery 44 (5) (1999) 1084–1093.
[12] P.S. D’Urso, R.G. Thompson, R.L. Atkinson, M.J. Weidmann, M.J. Redmond, B.I. Hall, W.J.S. Earwaker, Cerebrovascular biomodelling: a technical note, Surg. Neurol. 52 (5) (1999) 490–500.
[13] P.S. D’Urso, G. Askin, J.S. Earwaker, G.S. Merry, R.G. Thompson, T.M. Barker, D.J. Effeney, Spinal biomodeling, Spine 24 (12) (1999) 1247–1251.
[14] P.S. D’Urso, O.D. Williamson, R.G. Thompson, Biomodeling as an aid to spinal instrumentation, Spine 30 (24) (2005) 2841–2845.
[15] M.T. Izatt, P.L. Thorpe, R.G. Thompson, P.S. D’Urso, C.J. Adam, J.W. Earwaker, G.N. Askin, The use of physical biomodelling in complex spinal surgery, Eur. Spine J. 16 (9) (2007) 1507–1518.
[16] O.A. von Arx, M.T. Izatt, P.L. Thorpe, R.G. Thompson, P.S. D’Urso, C.J. Adam, G.N. Askin, The use of physical biomodeling in complex spine surgery, In: O. Williamson (Ed.), Annual Scientific Meeting of the Spine Society of Australia, 20–22 April, 2007, Hobart, Australia.
[17] M. Poulsen, C. Lindsay, T. Sullivan, P. D’Urso, Stereolithographic modelling as an aid to orbital brachytherapy, Int. J. Radiat. Oncol. Biol. Phys. 44 (3) (1999) 731–735. 236 Titanium in Medical and Dental Applications
[18] R. Thompson, G. Lorenzetto, P. D’Urso, BioBuild software, in: I. Gibson (Ed.), Advanced Manufacturing Technology for Medical Applications, Professional Engineering Publishing Pty Ltd, London, 2006, pp. 105–122.
[19] P. D’Urso, Biomodelling, in: I. Gibson (Ed.), Advanced Manufacturing Technology for Medical Applications, Professional Engineering Publishing Pty Ltd, London, 2006, pp. 31–57.
[20] J. Imanishi, P.F. Choong, Three-dimensional printed calcaneal prosthesis following total calcanectomy, Int. J. Surg. Case Rep. 10 (2015) 83–87.
[21] J.L. Aranda, M.F. Jim�enez, M. Rodrı´guez, G. Varela, Tridimensional titaniumprintedcustom- made prosthesis for sternocostal reconstruction, Eur. J. Cardiothorac. Surg. 48 (4) (2015) e92–4.
[22] R.J. Mobbs, M. Coughlan, R. Thompson, C.E. Sutterlin III, K. Phan, The utility of 3D printing for surgical planning and patient-specific implant design for complex spinal pathologies: case report, J. Neurosurg. Spine 26 (4) (2017) 513–518. Anatomics 3D-printed titanium implants from head to heel 237