2-2-1-1 تأثیر هندسه سطح بر خواص بیوپزشکی ایمپلنت های تیتانیوم
فرآیند پیوند استخوانی وابستگی زیادی به توپوگرافی سطح دارد. این اثر به دلیل ویژگی های خاص تعامل بین بافت زنده و سطح ایمپلنت در طول جایگزینی پیوند است. در مرجع ]11[، تعامل بین سطح تیتانیوم با چقرمگی های مختلف و سلولهای تکثیرشده شرح داده شد. نمونه مورد ارزیابی شامل آلومینیوم سندبلاست دار پولیش یافته با لایه ای از تیتانیوم پوشش یافته می باشد. در نتیجه، نویسندگان صفحه ای با سطح شیبدار زبر ساختند. برای ارزیابی واکنش سلولی، استئوبلاست و فیبروبلاستها (به عنوان مثال سلولهای جوان از بافت همبند) روی نمونه ها تکثیر شدند (شکل 2-2-1).
متعاقباً، مقدار جامع سلولها در نمونه مورد ارزیابی قرار گرفت.
نتیجه مهمی براساس وابستگی زیر به دست می آید: هنگامی که زبری سطح افزایش می یابد، سرعت تکثیر برای استئوبلاستها افزایش و برای فیبروبلاستها کاهش می یابد (شکل 2-2-2). بنابراین، سطح زبر تیتانیوم برای کاشت استخوان مناسب تر است، زیرا باعث رشد بافت استخوانی شده و از محاصره شدن ایمپلنت ها توسط بافت همبند محافظت می کند. این نتایج در مورد تأثیر زبری نیز در ]12-16[ تأیید شد.
با این حال، افزایش زبری در اندازه میکرون تنها به دلیل بهبود خواص بیوپزشکی نیست. زبری در مرحله اول از رشد فیبروبلاستها و رانش استئوبلاستها جلوگیری می کند. رانش در سطوح صاف برای مدت طولانی اتفاق می افتد. برای سطح زبر، زمان رانش کاهش یافته و سپس منجر به تغییر شکل اسکلت سلولی به منظور چسبندگی بهتر می شود ]17[.

09میلیمتر 04میلیمتر 01میلیمتر sb
Ra = 5.70 μm Ra = 4.50 μm Ra = 2.48 μm Ra = 1.12 μm
شکل 2-2-1 میکروفوتوگرافی از سطح زبری های مختلف
قبل از اینکوباسیون (A)
و پس از 7 روز از اینکوباسیون استئوبلاستها (B)
و فیبروبلاستها (C) ]11[
به این نکته توجه کنید که هیچ وابستگی مستقیمی بین تکثیر و زبری در کل محدوده اندازه گیری وجود ندارد. آزمایش اینکوباسیون استئوبلاست ]18[ روی سطح پودرهای اکسید تیتانیوم مونودیسپرس متراکم شده انجام شد (شکل 2-2-3).
همانطور که نشان داده شده، تکثیر در نمونه هایی با زبری بالای میکرونی به حداکثر می رسد و سپس افت و کاهش اندازه نانو توسعه می یابد. این امر فرآیندهای مختلفی را در حین جذب و تکثیر استئوبلاستها روی اندازه میکرون و کاهش نانو نشان می دهد. به طور کلی این موضوع قابل پیش بینی است، زیرا بافتها به طور پیشفرض مشابه نیستند: یک سطح مولکولی از ساختار، یک ماتریس خارج سلولی با عناصری به اندازه زیر میکرون و سلول هایی با اندازه میکرون وجود دارد. نباید انتظار واکنش معادل روی برجستگی یک مقیاس متمایز را داشت.
پس از ارزیابی واکنشهای سیتولوژیکی درباره برجستگی میکرونی، اجازه دهید تا همان بحث را در مورد برجستگی های نانو نیز داشته باشیم. تعدادی مقاله به توصیف کارآیی ساختار این لایه سطحی می پردازند (یعنی ]19،20[)، اما هیچ تلاشی برای توضیح این نتایج نشده است. برای درک این فرآیند، مطالعات اصولی جالبتری هست که با هندسه کنترل شده دقیقی انجام می شود. روشهای کاربردی احتمالاً در ایمپلنتولوژی هیچ چشم انداز عملی ندارند، اما به درک مکانیزم فرآیندهای سطحی کمک خواهند کرد. لیتوگرافی با اچینگ یونی واکنش پذیر ]21[ برای تشکیل ساختارهای متناوب استفاده می شود که بسته های کلاژن را شبیه سازی می کند. این داده ها نشان دهنده اثربخشی تقلید و دقت در تنظیم ساختار واقعی کلاژن است (شکل 2-2-4). همچنین قابل ذکر است که نمونه مرجع (اچینگ + سندبلاست GAE) در حال حاضر یکی از مؤثرترین ایمپلنتهای مورد استفاده است ]22، 23[.
در مرجع ]24[، کارآیی برجستگی با مقیاس کوچکتر نشان داده شده است. یک لایه زیروژل TiO2 مزوپور با قطر منافذ 6 نانومتر با استفاده از روش سل-ژل روی سطح ایمپلنت پوشانده می شود. کاشت این نمونه ها پس از گذشت 3 هفته از جایگزینی پیوند باعث افزایش مدت زمان حذف می شود (شکل 2-2-5).

شکل 2-2-2 نرخ تکثیر استئوبلاستها (A) و فیبروبلاستها (B) روی سطح شیبدار زبری ]11[.
برای توضیح این اثر، آزمایشی با استفاده از محلول شبیه سازی شده بدن (SBF) انجام شد. این آزمایش رشد هیدروکسی آپاتیت در منافذ زیروژل را نشان داد. بنابراین، برجستگی نانو علاوه بر تقلید از بسته های کلاژن ممکن است در کانی سازی و چسبندگی منطقه ایمپلنت با هیدروکسی آپاتیت بیولوژیکی نیز تأثیرگذار باشد.
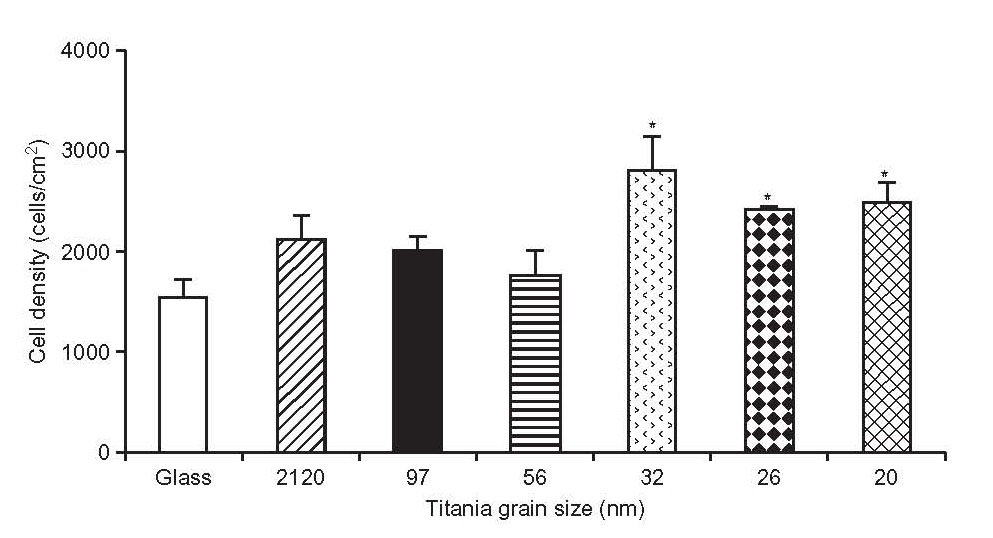
شکل 2-2-3 ارتباط بین تکثیر استئوبلاستها و میانگین اندازه دانه اکسید تیتانیوم است ]18]

شکل 2-2-4 نمونه های تیتانیوم به دست آمده به وسیله لیتوگرافی با استفاده از RIE با یک پله nm 1000 (A)، nm 300- رابطه شیار/خط مرزی = nm 225/75 (B)، nm 300 (C) و nm 150 (D) و پارامترهای BIC مربوطه پس از گذشت 4 هفته از کاشت ]21[
پیشنهاد منطقی در نظر گرفتن ترکیبی از برجستگی ها با اندازه های میکرو و نانو در همان ایمپلنت است که می تواند به طور قابل توجهی خواص پزشکی آن را بهبود ببخشد. تحقیقات زیادی در این زمینه وجود دارد ]25-29[. مرجع ]30[ برای ارزیابی کارآیی این نمونه مثال زدنی است: سطح فلزی تیتانیوم اچ شده با اسید به منظور ایجاد برجستگی میکرونی است. این امر منجر به ظهور حفرات ریز می شود. پس از آن، نانوندولها با پاشش روی سطح رشد خواهند کرد. در مرحله بعدی، مطالعات سیتولوژیکی روی نمونه هایی از ندولها با قطرهای مختلف، با توجه به تیتانیوم اچ شده با اسید انجام شد. چسبندگی سلولها به دلیل برجستگی میکرونی در هر دو نمونه باید یکسان باشد؛ با این حال، افزایش آشکار ناشی از هم افزایی وجود دارد (شکل 2-2-6).
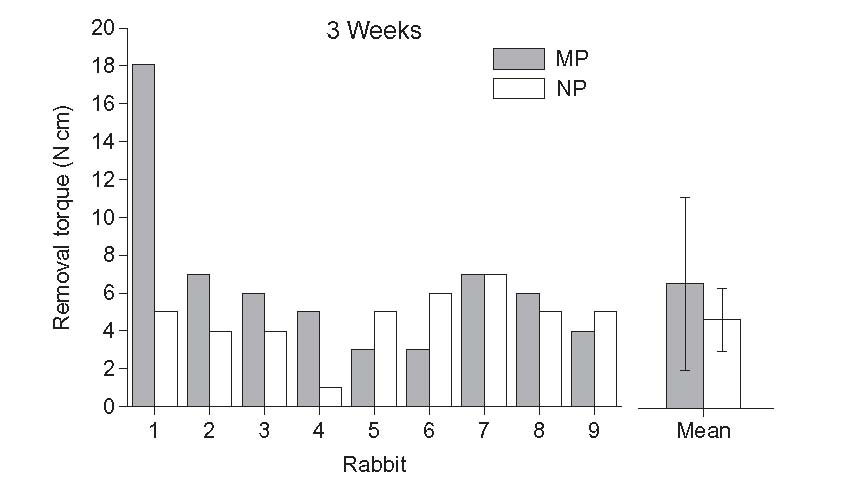
شکل 2-2-5 نتایج آزمایش RTT از ایمپلنت ها با یا بدون پوشش مزوپور ]24]
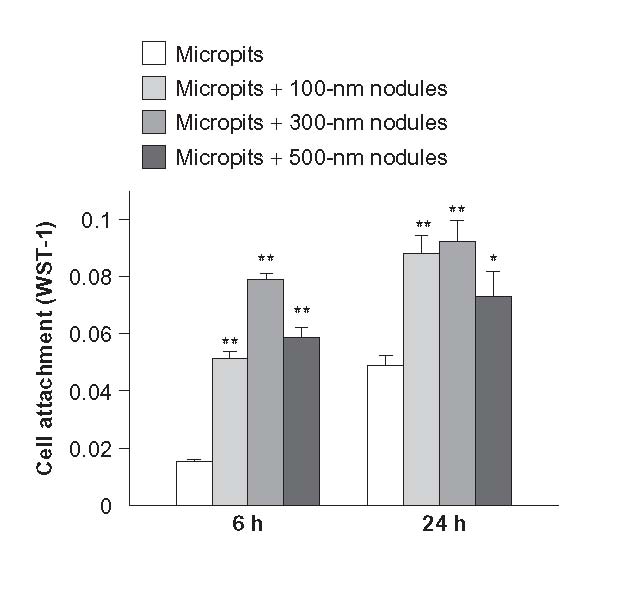
شکل 2-2-6 ارتباط چسبندگی سلولی به نوع ساختار سلسله مراتبی دو ترازه از سطح تیتانیوم [30]
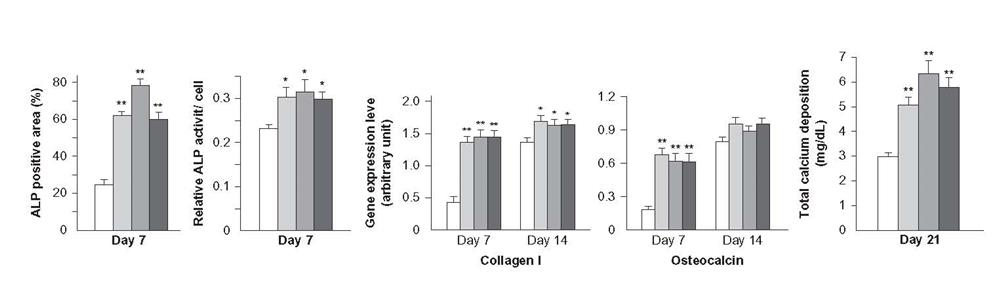
شکل 2-2-7 ارتباط پارامترهای بیوشیمیایی سلولهای تعیین کننده پوکی استخوان از نوع ساختار سلسله مراتبی دو ترازه از سطح تیتانیوم است [30]
برای پارامترهای دیگر سیتولوژیکی، تفاوت قابل توجهی نیز مشاهده شد (شکل 2-2-7). در نمونه هایی با سلسله مراتبی برجستگی دو ترازه، غلظت آلکالین فسفاتاز (که در تشکیل آنیونهای ارتوفسفات- ماده معدنی بافت جامد مشارکت می کند) و همچنین میزان کلسیم در طول دوره اینکوباسیون بالاتر بود. علاوه بر این، عبارت بالا میزان ژنها را برای تولید استئوکلسین و کلاژن یافت.
بنابراین، ما بر این نکته تأکید می کنیم که امیدوارکننده ترین روش اصلاح هندسی سطح، ایجاد سلسله مراتبی برجستگی دو ترازه است. این سیستم نه تنها ترکیبی از اثرات توپوگرافی در مقیاس میکرو و نانو، بلکه اثر هم افزایی این دو تراز ساختاری را نیز نشان می دهد.
2-2-2 روشهای کلاسیک اصلاح هندسی سطح ایمپلنت های تیتانیوم
2-2-2-1 عملیات سطحی مکانیکی
هدف اصلی از این نوع اصلاح، ایجاد بی نظمی های مناسب سطح ایمپلنت به منظور چسبندگی استئوبلاستها است. این بی نظمی ها منجر به کاهش دوران القاء رشد استخوان روی سطح ایمپلنت می شود. یکی از متداول ترین روشها، پردازش ساینده است. ساینده ها یا به صورت محدود (میله ها، ورقه های مدور و تسمه های ساینده زینتر یا سمنت شده) یا به صورت پودر آزاد استفاده می شوند. برای عملیات سطحی، پودرها را می توان به صورت سوسپانسیون در مواد فیبری مانند نمد اداره کرد. متناوباً، جریان محیط با ساینده ایجاد می شود. برای محیط مایع، انفجار ساینده مرطوب و برای محیط گازی، سندبلاست نامیده می شود. روش دوم اغلب در بخش علمی و همچنین عملی یافت می شود، زیرا از سندبلاست برای عملیات سطحی ایمپلنت های دندانی تیتانیوم استفاده می شود.
در مرجع ]31[، نویسندگان تأثیر سندبلاست بر خصوصیات بیوپزشکی ایمپلنت های تیتانیوم را توصیف می کنند. در ابتدا نمونه های تیتانیوم به وسیله ماسه با اندازه دانه های مختلف پردازش می شدند (جدول 2-2-1).
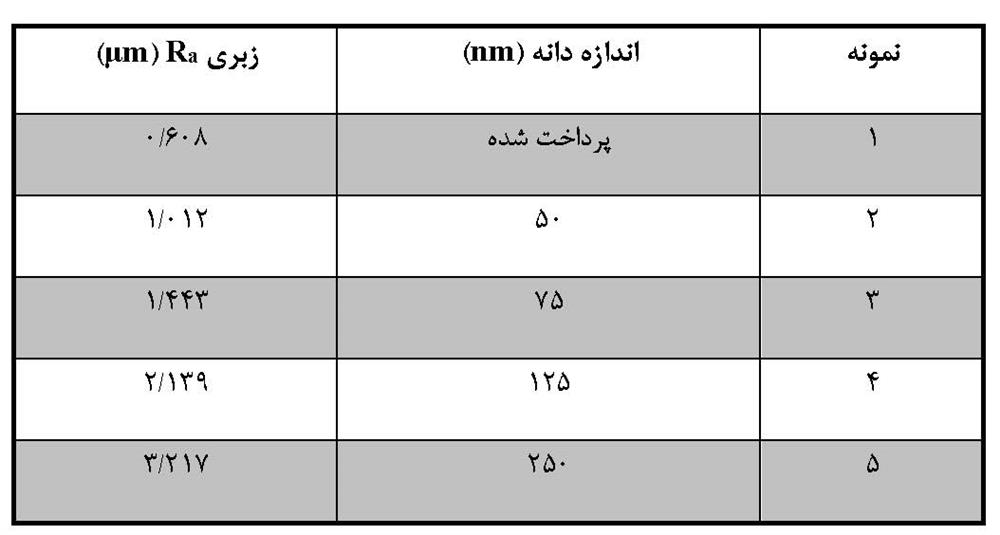
جدول 2-2-1 اندازه دانه ساینده و زبری نمونه های تیتانیوم
استئوبلاستها در این نمونه ها تکثیر شدند. بعد از اتمام دوران اینکوباسیون، آنالیز غلظت آلکالین فسفاتاز انجام شد. ظاهر این آنزیم نشانگر شروع کانی سازی بافت استخوانی است. در شکل 2-2-8، منحنی های مهار قلیایی آلکالین فسفاتاز همراه با فعالیت فسفاتاز روی نمونه هایی با زبری های مختلف آورده شده است.
در بازبینی اثر، نتیجه به دست آمده تأثیر مثبت زبری با اندازه میکرون را نشان می دهد. با این حال، نویسندگان این را تنها براساس روشهای سایتومتری پایه گذاری می کنند، در حالی که فاکتورهای جایگزینی پیوند باید از دیدگاه بافت شناسی تأیید شوند. اولین استدلال برای تأیید، رشد بافت موردنیاز روی سطح ایمپلنت است. استدلال دوم (که بیشتر به مباحث بیومکانیکی تعلق دارد تا بافت شناسی)، تعیین حذف گشتاور نیرو از بافت پس از جایگزینی پیوند است. آزمایشات بافت شناسی نتایج سیتولوژی را کاملاً تأیید می کند. در مرجع ]32[، رشد بافت روی سطوح زبر و صاف توصیف شده است؛ سطوح زبر معمولاً اتصالات محکمی را با بافت های جامد ایجاد می کنند، در حالیکه سطوح صاف را می توان با بافت اتصال دهنده محصور کرد. با این وجود، گاهی اوقات مطالعه بافت برای تصمیم گیری نهایی درباره کارایی اصلاح سطح کافی نیست؛ زیرا کاشت استخوان (به ویژه در واحدهای دندانپزشکی) باید به هنگام بارگیری، نگهدارنده ایمپلنت مکانیکی را فراهم کند. بنابراین، علاوه بر مطالعه کلاسیک مورفولوژی بافت، آزمایشهای بیومکانیکی اضافی موردنیاز است که می تواند اتصال ضعیف بافت را با ایمپلنت تشخیص دهد. چنین روش هایی به طور کلی ارتباط بین زبری و پیوند بافت استخوانی را تأیید می کنند. در مرجع ]33[، ایمپلنت های مسطح و سندبلاست شده در داخل استخوان خرگوش پیوند زده شدند. پس از سه ماه، حذف گشتاور نیرو اندازه گیری شد. برای مجموع سریهای دوم، این پارامتر بالاتر بود. بنابراین می توان نتیجه گرفت که زبری روی جایگزینی پیوند تأثیر مثبت دارد. با این حال، این یک پارامتر واضح نیست، زیرا چندین پارامتر جانبی نیز اتفاق می افتد ]34[.
در مرجع ]35[، اینگونه بیان شده که توصیف توپولوژی سطح تنها با استفاده از مقدار انتگرال کلاسیک Ra واضح نیست؛ زیرا فقط انحنای سطح کلی را توصیف می کند. در عین حال، توصیف توپولوژی کامل باید شامل میانگین فاصله بین پیک ها، میانگین ارتفاع پیک ها و غیره باشد. علاوه بر این، ساینده ها اغلب ساختارهای ناهمسانگردی را تشکیل می دهند (شکل 2-2-9) ]36[، که باید علاوه بر این، توسط پارامترهای بردار توصیف شوند.
در حال حاضر، سوالاتی درباره توپولوژی ایده آل به منظور بهبود سطح تولید شده توسط ماشینکاری باقی مانده اما روند کلی کاملاً بدیهی است.
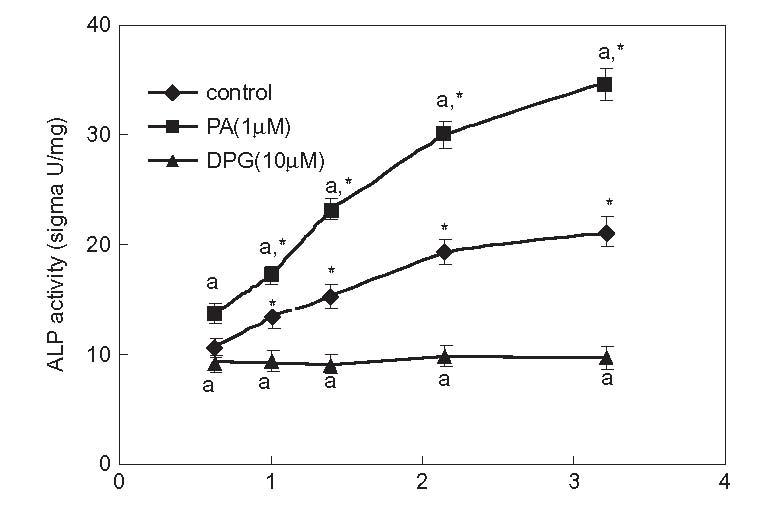
شکل 2-2-8 ارتباط فعالیت آلکالین فسفاتاز از روی زبری نمونه های تیتانیوم سندبلاست شده ]31[.

شکل 2-2-9 میکروفوتوگرافی های الکترونی سطح تیتانیوم: پرداخت شده (A) و ساینده پردازش شده (B) ]36[
2-2-2-2 اچینگ
اچینگ روش حذف لایه سطحی با استفاده از معرف های شیمیایی است. سه رویکرد اصلی وجود دارد: اچینگ شیمیایی، الکتروشیمیایی و پلاسمایی. اچینگ شیمیایی، قدیمی ترین روش شناخته شده است. بخشی از ماده به دلیل واکنش با اچانت حذف می شود- ترکیبی که ماده نمونه را نسبت به شکل محلول یا گاز تغییر می دهد. اچینگ الکتروشیمیایی، اچ کردن سطح رسانا به دلیل اکسیداسیون ماده در حین واکنش الکتروشیمیایی اکسایش-کاهش است. از این نمونه به عنوان آند حل شدنی استفاده می شود که در محلول الکترولیتی قرار می گیرد یا ذوب می شود؛ کاتد نیز در همان جا قرار دارد. پس از آن، جریان روی این سلول اعمال می شود. در نتیجه، ماده آندی در طی فرآیند الکتروشیمیایی حل می شود:
Me – e – = Me+aq
اگر واکنش در منطقه نفوذ پیش رود، زبری متناسب است و این روش، فرآیند پرداخت الکتروشیمیایی است. اچینگ در منطقه جنبشی منجر به لیچینگ ساختار متخلخل می شود.
نوع سوم اچینگ، اچینگ پلاسمایی است: حذف ماده از سطح به وسیله بمباران یون پلاسما. مؤثرترین روش، اچینگ یونی واکنش پذیر است؛ در این روش از ترکیب اچانت، پاشش یونی و فعالسازی یونی استفاده می کنند. همچنین منجر به حذف لایه سطحی و دفع سطحی محصولات واکنش فرار می شود.
اجازه دهید کاربرد روشهای اچینگ بازبینی شده برای اصلاح سطوح ایمپلنت را در نظر بگیریم. چندین اثر به مطالعه اچینگ اسیدی سطح تیتانیوم اختصاص یافته است. سیستماتیک ترین تحقیقات در این مقاله انجام شده است ]37[. بیست نوع ایمپلنت یکسان (3x4, 25mm) آماده شدند. ده نفر از آنها تحت عمل جراحی قرار گرفتند؛ سطح آنها به وسیله شکاف های ساینده ناهمسانگرد با مقیاس میکرون حالت مسطح را نشان می دهند (شکل 10-2-2)، در حالیکه اچینگ شیمیایی منجر به توپولوژی توسعه یافته سطح می شود (شکل 2-2-10 B).

شکل 2-2-10 میکروفوتوگرافی الکترونیکی از سطوح ایمپلنتهای تیتانیوم (A) پرداخت شده؛ (B) اچ شده با اسید ]37[
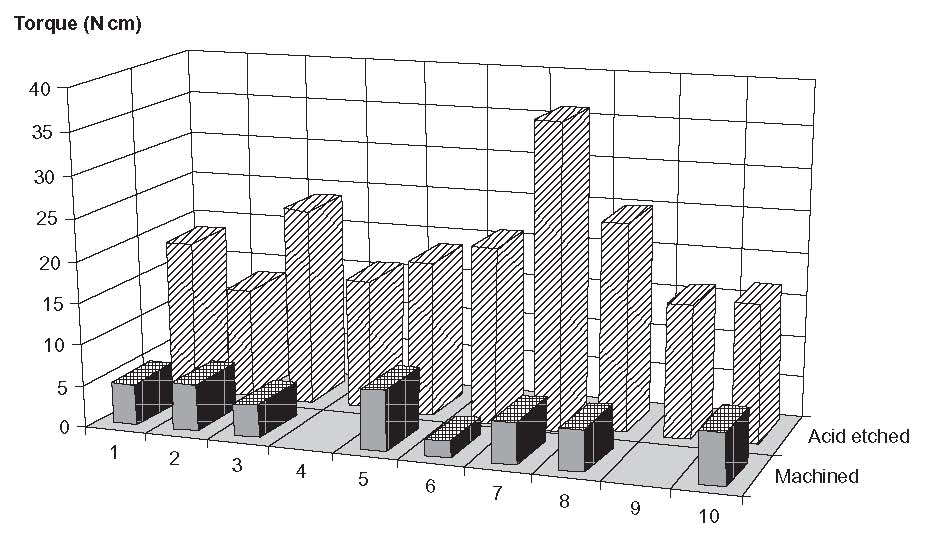
شکل 2-2-11 گشتاورهای نیرو از حذف ایمپلنت ها در استخوان ]37[
اچینگ اسیدی با محلولهای آبی H2SO4 یا HCl انجام شده است. علاوه بر این، خرگوش هایی با وزن 4.5 تا 5.5 کیلوگرم تهیه شدند. سطح صاف روی دیستال جانبی استخوان ران جهت جایگیری ایمپلنت انتخاب شد. سپس، سوراخهایی با استفاده از یک مته مخروطی ایجاد شدند. ایمپلنتها داخل سوراخها پیچیده و سپس بافتها ترمیم شدند. پس از آن، خرگوشها به مدت 2 ماه با تغذیه آزاد و بدون محدودیت نگهداری شدند. علاج و سلامتی به وسیله اٌتانازی شیمیایی دنبال شد. متعاقباً هر ایمپلنت از نظر جراحی ترخیص و از نظر بالینی آنالیز شد. فقط دو ایمپلنت از 10 مورد که به صورت مکانیکی تحت درمان قرار گرفته بودند، جایگزینی پیوند مورد انتظار را از خود نشان ندادند- حذف گشتاورهای نیرو در این دو مورد کمتر از حساسیت دستگاه بود. 18 ایمپلنت باقیمانده آزمایش را با موفقیت پشت سر گذاشتند. این نتایج در شکل 2-2-11 نشان داده شده است. بنابراین، نویسندگان به این نتیجه رسیده اند که اچینگ منجر به واکنش عالی بافت استخوانی می شود و بنابراین این روش چشم اندازی برای توسعه ایمپلنت ها با جایگزینی پیوند بهبود یافته است. علاوه بر اچ کردن ماده با مخلوطی از اسیدهای سولفوریک و هیدروکلریک، سایر ترکیبات اچینگ نیز شناخته شده هستند که نتایج مثبتی را نیز نشان می دهند:
محلول آبی HF، HCl، H2SO4- ]38[.
محلول آبی HF- ]39[.
محلول آبی HCl، H2O2 - ]40[.
محلول آبی HF، HNO3 - ]41[.
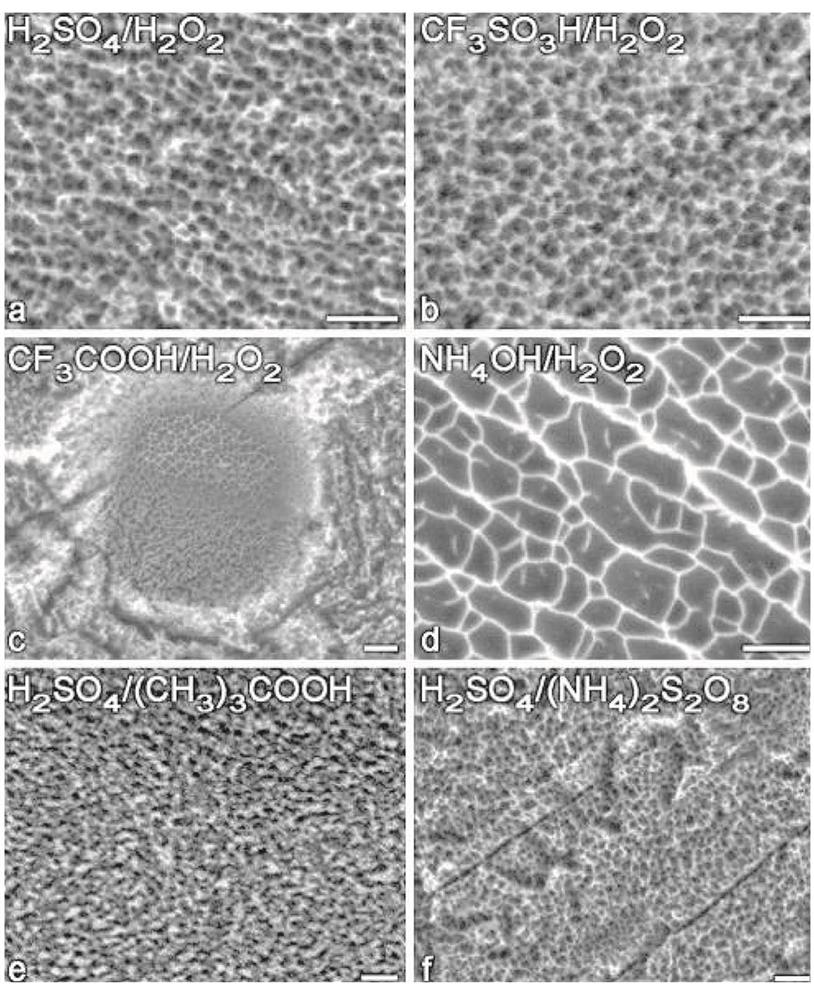
شکل 2-2-12 میکروفوتوگرافی الکترونیکی نمونه ها که توسط عوامل مختلف اچینگ انجام شده اند ]45]
Reprinted from F. Vetrone, F. Variola, P. Tambasco de Oliveira, S.F. Zalzal, J.-H. Yi, J. Sam, K.F. Bombonato-Prado, A. Sarkissian, D.F. Perepichka, J.D. Wuest, F. Rosei, A. Nanci, Nanoscale oxidative patterning of metallic surfaces to modulate cell activity and fate, Nano Lett. 9 (2) (2009) 659–665. Copyright (2009) American Chemical Society.
کاربرد امیدوارکننده این روش نه تنها به وسیله آزمایشات in vitro و in vivo روی حیوانات بلکه به وسیله آمار کاشت برای بیماران واقعی نیز تأیید شده است ]42[. یکی دیگر از جنبه های مهم اچینگ شیمیایی، ظهور بافت منظم روی سطح تیتانیوم هنگام استفاده از عوامل اچینگ است. برخی از میکروفوتوگرافی های نمونه های اچ شده توسط روشهای مختلف در ]45[ (شکل 2-2-12) آورده شده است.
همانطور که مشاهده می شود، همه عوامل اچینگ سوراخ های کوچکی با قطرهای مختلف ایجاد می کنند. در مورد سیستم محلول آمونیاک- هیدورژن پراکسید، شبکه ای از ترکهای متصل مشاهده می شود. علاوه بر تأثیر اچانت در ]43،44[، تأثیر ساختار دانه تیتانیوم روی بافت سطح پس از اچینگ نیز بررسی شده است. این موضوع مسیر بسیار جالبی دارد، اما در حال حاضر تأثیر بافت به طور کامل درک نشده است. با جمع بندی این بخش، لازم به ذکر است که اچینگ سطح از نقطه نظر کاربردی روشی ساده است. با استفاده از گزینه های متنوع قابل اجرا و طیف وسیعی از اچانت ها، می توان طیف وسیعی از بافتهای سطحی از جمله موارد مناسب برای بهبود زیست فعالی تیتانیوم را ایجاد کرد.

شکل 2-2-13 میکروفوتوگرافی الکترونیکی سطح آلیاژ تیتانیوم آندی شده ]46[
2-2-2-3 آنودیزاسیون
اچینگ الکتروشیمیایی می تواند بدون انحلال کامل ماده آندی در اچانت انجام شود. در این حالت، یک لایه اکسیدی روی سطح رشد می کند. این آندیزاسیون به طور گسترده برای اصلاح سطوح ایمپلنت تیتانیوم استفاده می شود ]45-47[. در مرجع ]46[، میکروفوتوگرافی های سطح آلیاژ Ti پس از آندیزاسیون در اسید سولفوریک آبی داده می شود (شکل 2-2-13). بنابراین، می توان حضور بافتی با اندازه نانومتری را روی سطح نمونه مشاهده کرد. در بزرگنمایی کمتر، یک بافت توسعه یافته ضعیف با اندازه میکرون می تواند ظاهر شود (شکل 2-2-14). بنابراین، این روش همچنین برای توسعه ایمپلنت در آینده مؤثر است. این روش حتی زمانی که آثار توصیفی در آرایش سازه ها، در امتداد خط ناظم تا سطح به صورت ناهمسان گرد است، جذابتر به نظر می رسد. تحت شرایط خاص، تمرکز در نقطه بخصوصی از بار درطی آندیزاسیون روی مناطقی با سرعت اچینگ بالا اتفاق می افتد. در نتیجه، این مناطق عقب نشینی کرده و شبکه ای از منافذ هگزاگونال اعوجاج یافته ایجاد می شوند ]48[ (شکل 2-2-15).
چنین ساختاری واکنش سلولی خوبی دارد. بنابراین، در مرجع ]49[، همان نانولوله ها در اصل روی سطح اچ شده تیتانیوم به دست آمد. این ساختارها تأثیر قابل توجهی در تکثیر استئوبلاست نداشتند؛ با این حال، افزایش زیاد فعالیت آلکالین فسفاتاز کشف شد که نشان دهنده پیشرفت قابل توجه از روند تمایز است. مطالعات بعدی نشان داد که تأثیر آن روی سطوح پس از آندیزاسیون کلاسیک کمتر بیان می شود ]50[.
بنابراین، می توان نتیجه گرفت که آنادایزینگ برای ایجاد پوشش های فعال زیستی مناسب و استفاده از سطوح شبه پایه بسیار کارآمد است.

شکل 2-2-14 میکروفوتوگرافی الکترونیکی سطح آلیاژ تیتانیوم آندی شده ]46[ با بزرگنمایی کمتر
Reprinted from N. Masahashi, Y. Mizukoshi, S. Semboshi, K. Ohmura, S. Hanada, Photo-induced properties of anodic oxide films on Ti-6Al-4V, Thin Solid Films 520 (2012) 4956–4964. Copyright (2012), with permission from Elsevier.

شکل 2-2-15 میکروفوتوگرافی الکترونی سطح تیتانیوم متخلخل (لولهای) آندی شده (A). میکروفوتوگرافی الکترونی از یک تراشه از سطح (B) ]48[.
2-2-2-4 پوشش مواد بر پایه TiO2
بخشهای قبلی با حذف بخشی از ماده ایمپلنت به روشهای بافت دهی سطح اختصاص یافتند. در این بخش، روشهای مورد استفاده برای پوششهای تیتانیومی را بررسی خواهیم کرد، که به ما امکان به دست آوردن سطحی با توپولوژی مشخص، بدون تغییر در بالک ایمپلنت را می دهد. روشهای پوشش به روشهای فیزیکی و شیمیایی تقسیم می شوند. در گروه اول، این روشها فرآیندهایی مثل ترسیم مکانیکی، تراکم گاز و رسوب مایع است. همانطور که می بینید، ماده در جریان پوشش متحمل تغییرات در ترکیب نمی شود. در گروه دوم روشها، ماده پوشش نسبت به ماده ای که برای به دست آوردن معرف های اولیه استفاده می شود، دارای ترکیب متفاوتی است. چندین روش وجود داد: استفاده از روکش رنگ و لاک با پلیمریزاسیون در یک لایه نازک، رسوب شیمیایی به واسطه فاز گازی، روش سل-ژل و غیره. در این فرآیندها، روشهای فیزیکی نیز حداقل برای انتقال روی سطح زیرلایه موردنیاز است. بنابراین، روشهای شیمیایی پیچیده تر هستند و در عین حال مستلزم پیشرفت واکنش لازم و همچنین متمرکز کردن واکنش روی سطح در یک نقطه بخصوص می باشند. هر روشی مزایا و معایبی دارد و بهتر است با دقت بیشتری جزئیات آنها را در نظر بگیریم.

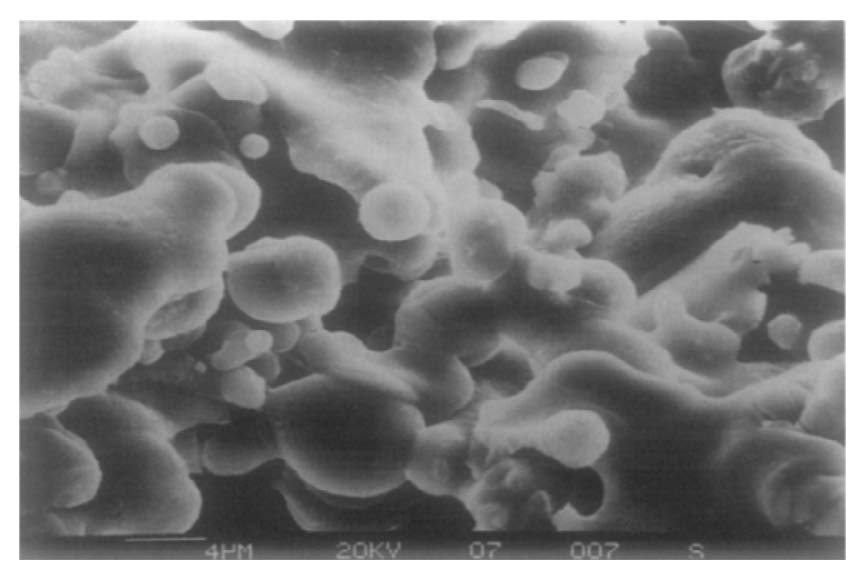
شکل 2-2-16 بافت سطح به دست آمده از طریق پاشش حرارتی گازی اکسید تیتانیوم ]53[
2-2-2-4-1 روشهای فیزیکی مورد استفاده در پوش شدهی بافت بر پایه اکسید تیتانیوم و تیتانیوم به منظور افزایش فعالیت زیستی ایمپلنت
2-2-2-4-1-1 پاشش حرارتی گازی
تعدادی از آثار پاشش حرارتی به تولید پوششهای تیتانیومی اختصاص دارد. در نگاه اول، رسوب یک لایه تیتانیومی روی سطح تیتانیومی مفهومی ندارد. در حقیقت، اگرچه این روش برای فرایند پیوند سریعتر استخوان بسیار امیدوارکننده است، زیرا رسوب ممکن است در حالت رشد مداوم فیلم یا در شکل گیری بی نظمی های تعریف شده انجام شود، اما می تواند واکنش سلولی هم در بر داشته باشد. این روش شامل حرارت دهی، دیسپرس کنندگی و انتقال ذرات رسوب از ماده کندوپاش شده به وسیله جریان گاز است که منجر به تشکیل لایه رسوب روی سطح زیرلایه می شود. اجرای این کار واقعاً ساده است: از یک مشعل استفاده می شود که ذرات فلزی را با شعله انتقال می دهد. علیرغم سادگی، این روش بسیار تأثیرگذار است، زیرا ذرات تیتانیوم رسوب شده به ایمپلنت جوش داده می شود. این جوش منجر به چسبندگی بالا شده و در نتیجه ذرات تا حد زیادی شکل اصلی خود که منجر به بافت سطحی می شوند را حفظ می کنند (شکل 2-2-16).
در کار، نمونه های اکسید تیتانیوم کندوپاش شده روی تیتانیوم، از پودرهایی با اندازه دانه های مختلف به دست آمدند. در طول اندازه گیری سیتولوژی، مشخص شد که تکثیر سلولی روی سطح اصلاح شده سریعتر اتفاق می افتد. وابستگی شدید نتیجه کار نیز با تغییر اندازه دانه در ذرات پودر و دمای رسوب لحاظ شد.
2-2-2-4-1-2 رسوب بخار فیزیکی
روشهای مختلفی برای اجرای این روش وجود دارد: نزدیکترین روش به روش پاشش حرارتی فوق الذکر، پاشش پلاسمایی اتمسفری است. در اینجا، ماده پوشش در میان جت پلاسمای ایجاد شده توسط قوس الکتریکی که خود ماده در آن تحت یونیزاسیون قرار دارد، وارد می شود. پوشش دهی در حالت اتمسفر خنثی ترجیح داده می شود، زیرا واکنش ماده اسپری شده با هوا را حذف می کند. معمولاً این تغییر پاشش پلاسمایی در اتمسفر کنترل شده یا پاشش پلاسمایی خنثی نامیده می شود. در صورت نیاز به تولید پوشش تحت شرایط میانی روش لایه نشانی کندوپاش استفاده می شود. این روش بر پایه بمباران هدف کندوپاش با یونها است. در نتیجه، یونها از ماده بیرون کشیده شده و متعاقباً روی زیرلایه متراکم می شود. برای به دست آوردن چنین شرایطی، می توان از پلاسما با گاز بی اثر استفاده کرد که معمولاً توسط مگنترون یا پتانسیل الکتریکی بالا (لکه کاتدی) تولید می شود. روش کندوپاش را به دلیل تأثیر اندک روی زیرلایه می توان برای ایجاد ایمپلنت کامپوزیتی استفاده کرد، زیرا به ما این امکان را می دهد تا سطحی مشابه با بالک تیتانیوم، آلیاژهای آن و حتی موادی که به تیتانیوم مربوط نیستند، ایجاد کنیم. همچنین برای هدفهای کندوپاش در حالت خلأ می توان از کوره مقاومتی (پاشش حرارتی)، لیزر (کندوسوز لیزری) و حتی برخی از روشهایی که خیلی رایج نیستند، استفاده کرد.
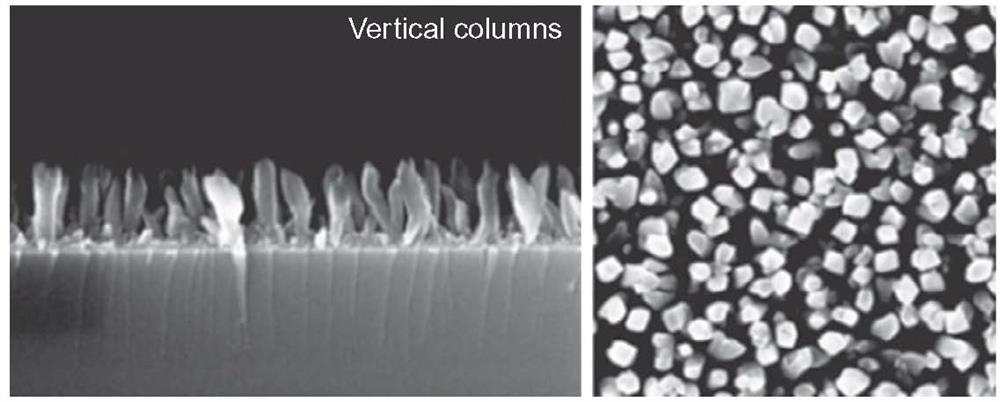
روشهای لایه نشانی کندوپاش می توانند هم در حالت رشد مداوم فیلم و هم در حالت رشد گرانولی فیلم (شکل 2-2-17) ]51[، و حتی برای اهداف ناهمسانگرد (شکل 2-2-18) نیز کار کنند.
نوع دوم سطح، بسیار جالب و جزئی شبیه به بافت سطح آنودایز شده لوله ای است ]49[. در مرجع ]52[، داده ها جذب سلول و شتاب متمایز آنها روی این سطح و همچنین وقوع پای کاذب غیر طبیعی کوچک استئوبلاستها که ممکن است باعث چسبندگی بافت استخوان با سطح شود را نشان می دهد. علاوه بر این، نویسندگان بر حجم قابل توجهی از حفرات مناسب برای پر کردن انواع مختلف داروها تأکید دارند. لازم به ذکر است که سطوح دارای حفرات ]45،46 ،38،51[ و لولهها ]49[ نیز برای پر کردن مناسب هستند، اما این موضوع هدف مورد بررسی ما نخواهد بود.
علاوه بر بافت، پوششهای بر پایه تیتانیوم می توانند مانعی برای انتشار یونی سمی از بالک ایمپلنت باشند. بنابراین، در مرجع ]53[ ایمپلنت ساخته شده از آلیاژ Ti-6Al-4V خواص مکانیکی بهتری نسبت به تیتانیوم خالص دارد، اما به دلیل وجود وانادیوم از زیست سازگاری نامناسبی برخوردار است. این ایمپلنت با یک لایه تیتانیوم با ضخامت 100 میکرون توسط پاشش پلاسمایی در اتمسفر کنترل شده پوشش داده شد. در نتیجه، این سطح در طی انجام آزمایشات سیتولوژی خصوصیات خوبی را از خود نشان می دهد.
علاوه بر روشهای رسوب بخار فیزیکی، بسیاری روشهای دیگر نیز وجود دارند اما برای رسوب پوشش تیتانیوم یا برای رسوب دهی روی زیرلایه تیتانیوم مناسب نیستند. با این حال، در مقالات علمی پزشکی مربوط به ایمپلنت های تیتانیوم، رایج ترین روش پاشش است.
شکل 2-2-17 ساختار پوشش تیتانیومی تولید شده به روش پاشش پلاسمایی خلأ [51]. در مورد اول ما با سطح سروکار داریم، که مشابه با عملیات آندی کلاسیک است
شکل 2-2-18 میکروگراف الکترونی از پوششهای تیتانیومی شبه توده ای تولید شده از رسوب پلاسما در زوایای خراش [52]
2-2-2-5 روشهای شیمیایی استفاده از پوشش بافتی بر پایه اکسید تیتانیوم برای افزایش فعالیت زیستی ایمپلنت ها
2-2-2-5-1 رسوب بخار شیمیایی
رسوب بخار فیزیکی که قبلاً در مورد آن بحث کردیم، یک حالت شیمیایی مشابه دارد: رسوب بخار شیمیایی یا CVD. این روش شیمیایی برای تولید فیلم های نازک و اجسام بزرگ و همچنین برای به دست آوردن مواد بسیار خالص استفاده می شود. در مورد کاربرد فیلم های نازک ساخته شده با این روش، زیرلایه به صورت یک جفت از یک یا چند ماده قرار می گیرد که در طول واکنش متقابل یا تجزیه به عنوان لایه محصول روی سطح قرار می گیرد. محصولات واکنش معمولاً با استفاده از گاز حامل یا خلأ از راکتور و سطح زیرلایه مورد بحث حذف می شوند.
با این حال، با وجود مجاورت روش های رسوب دهی فیزیکی و شیمیایی، جستجوی کارها برای به دست آوردن پوششها با روش CVD پیشرفت بسیار ضعیفی در منطقه را نشان می دهد: تعداد کم نشریات و عدم وجود رویکرد سیستماتیک برای آنالیز پارامترهای بیولوژیکی. بنابراین در مقاله ]54[ که درباره به دست آوردن پوشش TiO2 روی ایمپلنت های دندانی توسط CVD است، خواص ضد باکتریایی مورد بررسی قرار گرفته، در حالیکه نه آنالیز سلول بقاء و نه مطالعات سیتولوژی انجام نشده است. بنابراین، باید نتیجه بگیریم که با وجود چشمانداز بکارگیری روش CVD برای ایجاد نانو بافت روی سطح ایمپلنت های تیتانیومی، این منطقه به طور تقریبی تاکنون ناشناخته باقی مانده است. بسیاری از نمونه های این روش کاربردی، نه تنها به هندسه اکسید بلکه به معرفی ترکیبات اضافی در یک لایه تیتانیومی روی سطح نیز مرتبط هستند.
2-2-2-5-2 روش سل-ژل
روش دیگر ایجاد پوشش بافتی روی سطح ایمپلنت، روش سل-ژل است. مانند روش قبلی، این روش به مواد شیمیایی اشاره دارد: که شامل تشکیل ماده جامد یا پوشش به وسیله چگالش در طول فرآیند سل-ژل است. با توجه به روش در نظر گرفته شده، ژلهای تهیه شده از سُلها، شبکه ای از نانوذرات متراکم پر شده با مایع اصلی و همچنین حاوی محصولاتی از واکنش چگالش هستند. حذف محلول (محیط پاشندگی) منجر به ایجاد اجسام جامد به اصطلاح "xerogels" (زیروژلها) می شود که با ذرات حل شده متقاطع ترکیب شده است. این پوشش به دلیل وجود فضای داخلی پر نشده در قالب پس از حذف محیط پاشندگی معمولاً از تخلخل بالایی برخوردار است. ویژگی بارز این روش، بارش ژل به اصطلاح "soft chemistry" است، یعنی واکنش در دماهای پایین اتفاق می افتد و معمولاً نیازی به شرایط خاص دیگر مانند خلأ، آغازگر فعالسازی تحت فشار، تشعشع و غیره ندارند. این دلایل باعث جذابیت این روش از نظر کاربردهای تکنولوژیکی می باشد.
تعدادی مقاله وجود دارد که تولید یکپارچه ]55[، فیلم های اکسید تیتانیومی بدون تخلخل را با روش سل-ژل توصیف می کند. با این حال، کاربرد آنها به منظور ایجاد پوشش های زیست سازگار برای ایمپلنت های تیتانیوم معنی ندارد، زیرا تفاوت چندانی با اکسید تیتانیوم طبیعی ندارند. آثار جالبتر بر پایه ساخت فیلم های متخلخل هستند. در مرجع ]56[، روشی بسیار ساده اما اصلی برای ایجاد پوشش تیتانیومی توسط روش سل-ژل شرح داده شده که یک فیلم متخلخل از اکسید تیتانیوم هیدراته را نشان می دهد. این پوشش به واسطه سُل در دمای بالا با هیدرولیز تیتانیوم تترا ایزوپروپوکسید در محیط اسیدی رسوب داده شده است. و برای کاربرد، از روشی بسیار متداول با نام پوشش دهی غوطه وری استفاده می شود. این روش شامل استخراج زیرلایه با سرعت مشخصی از محلول است و در نتیجه یک فیلم روی سطح آن رسوب داده می شود. نتیجه به دست آمده لایه ای یکنواخت از اکسید متخلخل است. مطالعات سیتولوژیکی نشان داد که پوشش ها از واکنش سلولی خوبی برخوردار هستند؛ این پوشش ها همچنین منافذ مناسبی برای معرفی پروموتورهای مختلف فرآیند پیوند استخوانی دارند. درمورد رسوبدهی ژلها، می توان چگالشی ساده از ذرات سُل به دست آورد تا ساختاری متخلخل با توزیع اندازه منافذ کاملاً باز و هندسه های نامنظم حاصل شود. از روش قالبزنی برای ایجاد ساختارهای منظم استفاده می شود. در روش سل-ژل، این کار بر پایه ورود ماکرومولکولهای مختلف، خرده سنگها یا اجسام نانو درون ژل در طی چگالش است؛ حذف متعاقب آن نیز منجر به زیروژلهایی با منافذ در حال تکرار از فرم جسم شد. در مرجع ]24[، نویسندگان فیلم تیتانیای مزوپور را سنتز کردند. سنتز با استفاده از هیدرولیز تیتانیوم تترا ایزوپروپوکسید در محیط اسیدی با حضور قالب هسته زدایی- میسل سورفکتانت Pluronic P123 انجام شد. در غلظت های بالاتر از غلظت ثانوی، شکل دهی میسل بحرانی است، این ماده میسلهای استوانه ای را می سازد که می تواند به طور خودبخودی در بلور مایع ناهمسانگرد هگزاگونال ساخته شود. نویسندگان از این ویژگیها استفاده کرده اند: ژل که با وجود Pluronic P123 رسوب کرده، کامپوزیتی از ماتریس اکسید پر شده با ماده آلی است و خود ماده، ساختار کریستالی مایع را تکرار می کند. پس از حذف سورفکتانت، باقیمانده ها و مایعات اصلی کامپوزیت، زیروژلهایی با منافذ استوانه ای هگزاگونال تشکیل شد. برای رسوب فیلم، نویسندگان روشی را که اغلب استفاده می شود را انتخاب کردند- پوشش دهی چرخشی براساس اعمال محلول روی زیرلایه چرخشی و در نتیجه پخش محلول از مرکز آن تحت نیروی گریز از مرکز است. شکل 2-2-19 میکروفوتوگرافی الکترونی فیلم حاصل را نشان می دهد.
در تصویر اول (شکل A1-19)، می توان ساختار متخلخل منظم از فیلم حاصل را دید. در تصویر دوم (B1-19)، به دلیل حجم وسیعی از ساختار منافذ لایه برش خورده از طریق زیرلایه و دهانه منافذ نانومتری روی سطح، دسته های کمتری را می توان دید. فیلم های حاصل از هر دو آزمایشات in vitro و in vivo مورد آزمایش قرار گرفتند. در نتیجه مشخص شد که نیروی گشتاوری استخراج ایمپلنت بخصوص در زمان کم جایگزینی پیوند بالاتر از سطح نانومتخلخل است، زیرا در طول این مدت دقیقاً زمان اتصال به ایمپلنت (BIC) کم می باشد.

شکل 2-2-19 میکروفوتوگرافی الکترونی از فیلم های مزوپور اکسید تیتانیوم: انتقال (A) و تصویر میکروسکوپ الکترونی روبشی (B) [24]
2-2-3 روشهای تغییر سطح ایمپلنت هندسی مؤثر در آینده
برای ایجاد سلسله مراتبی دو ترازه از توپوگرافی
از روشهای اصلاح کلاسیک فوق الذکر می توان برای ایجاد سلسله مراتبی دو ترازه از توپوگرافی سطح ایمپلنت استفاده کرد. این امر به ترکیبی از روشهای ایجاد توپوگرافی با اندازه میکرون و نانومتری نیاز دارد. در بخش اول این فصل ما قبلاً به ترکیب روش های لایه نشانی کندوپاش کاتدی و اچینگ اسیدی اشاره کردیم ]30[: اچینگ منجر به ایجاد حفره با اندازه میکرون می شود، در حالیکه روش کندوپاش ندولهای تیتانیومی با اندازه های نانومتری ایجاد می کند (شکل 2-2-20).
چنین ساختار سطحی به طور قابل توجهی قابلیت استفاده زیستی ایمپلنت ها را افزایش می دهد. در مرجع ]25[، ترکیبی دوتایی از اچینگ اسیدی با رفتار آندی استفاده و منجر به رشد نانولوله هایی شد که معمولاً متمایل به سطح هستند (شکل 2-2-21).

شکل 2-2-20 میکروفوتوگرافی الکترونی از ساختار سطح تیتانیوم پس از اچینگ و ندولهای رسوب توسط کندوپاش کاتدی[30]

شکل 2-2-21 میکروفوتوگرافی الکترونی با وضوح پایین (A) و با وضوح بالا (B) از سطح تیتانیوم که در معرض اچینگ اسیدی و عملیات آندی قرار دارد [25]
همانطور که انتظار می رفت، چنین ساختاری از لایه سطح، واکنش سیتولوژی قابل توجهی را فراهم می کند. با این حال، نویسنده تحقیقات جالب دیگری را در مقایسه با اکثر آثار مرتبط انجام داده است: علاوه بر سطوح تیتانیومی خالص کلاسیک، نمونه ها پس از اچینگ و عملیات آندی به عنوان استاندارد نیز استفاده می شوند. در نتیجه، به وضوح می بینیم که این اثر دارای برجستگی با اندازه میکرون و نانومتری است اما ترکیب آنها در همان نمونه دارای هم افزایی کاملاً مشخص است (شکل 2-2-22).
در مرحله بعدی، ما بررسی دقیق مطالعات زیست فعال از انواع مختلف سطوح با ساختار دو ترازه از برجستگی ها را رد خواهیم کرد، همانطور که در تمامی مقالات ارائه شده، تأثیر مثبت اصلاح سازی مشاهده شده است. اجازه بدهید تا روشهای ایجاد برجستگی ها را در نظر بگیریم. در مرجع ]26[، با استفاده از ترکیبی از اچینگ قلیایی و اسیدی، ساختارهای به اصطلاح شبه لانه (nest-like) با سطح بسیار بزرگی به دست آمدند (شکل 2-2-23).
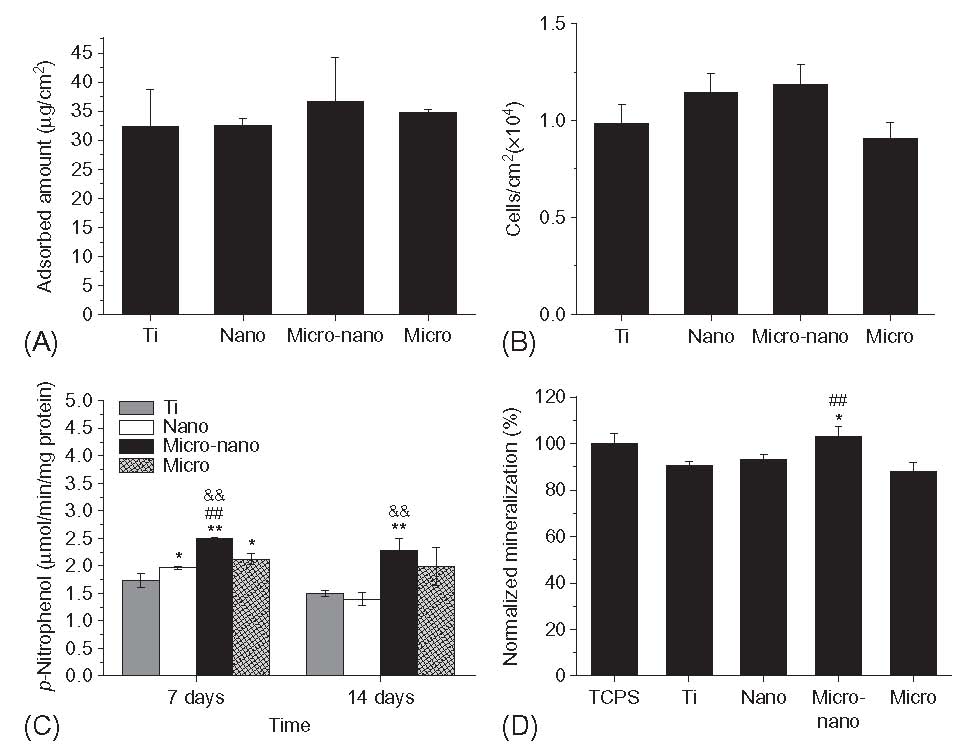
شکل 2-2-22 مقادیر انتگرال جذب پروتئین(A)، تعداد سلولها (B)، فعالیت آلکالین فسفاتاز(C) و کانی سازی نرمال(D) برای تیتانیوم خالص، تیتانیوم پوشش داده شده با نانولوله، تیتانیوم اچ شده پوشش یافته با نانولوله، و تیتانیوم اچ شده [25]

شکل 2-2-23 میکروفوتوگرافی الکترونی با وضوح پایین (A) و با وضوح بالا (B) از سطح تیتانیوم که در معرض اچینگ اسیدی و عملیات آندی قرار دارد [26]
ترکیب دیگری از روش های عملیات سطحی در مرجع ]29[ استفاده شد: زبری با اندازه میکرون توسط سندبلاست حاصل می شود، در حالیکه زبری با اندازه نانومتر توسط شستشوی قلیایی به دست می آید. این امر منجر به ظهور نانوصفحه های اکسید تیتانیومی شد (شکل 2-2-24).
یکی دیگر از روش های پیشرفته و امیدوارکننده از فناوری ساخت برجستگی دو ترازه در مرجع ]57[ ارائه شده است. برای ایجاد نانوبرجستگی، اکسیداسیون آندی فوق الذکر استفاده شد؛ که منجر به تشکیل نانولوله های اکسید تیتانیومی شد و برخلاف آثار قبلی، برجستگی با اندازه میکرون بدون فرسایش زیرلایه فلزی به دست آمد. تیتانیوم به وسیله دستگاه پاشش پلاسمایی خلأ پردازش شد. پودر تیتانیوم به عنوان ماده آغازگر به کار گرفته شد، که منجر به تشکیل برجستگی میکرونی توسعه یافته گردید (شکل 2-2-25).

شکل 2-2-24 میکروفوتوگرافی الکترونی از سطح تیتانیوم پس از سندبلاست، شستشوی قلیایی و عملیات حرارتی [29]

شکل 2-2-25 میکروفوتوگرافی الکترونی با وضوح پایین (A) و با وضوح بالا (B) از سطح تیتانیوم در معرض پاشش پلاسمایی و پس از آن با علمیات آندی تیتانیوم [57]
روش دیگر که در ماده ایمپلنت تأثیرگذار نیست، بافت دهی فیلم در طول عملیات حرارتی است. در مرجع ]58[، فیلم ژل TiO2 رسوب شده روی سطح تیتانیوم در معرض خشک کردن با شوک الکتریکی قرار گرفت و در نتیجه به علت از بین رفتن محیط پراکندگی، انقباض اتفاق افتاد. به منظور جبران تنش، ترکهای میکرونی روی فیلم شکل گرفت و برجستگی نانو در طول سنتز زیروژل از ژل تشکیل شد (شکل 2-2-26).

شکل 2-2-26 میکروفوتوگرافی الکترونی با وضوح پایین (A) و با وضوح بالا (B) از سطح تیتانیوم پوشش داده شده با زیروژل TiO2 به دست آمده توسط خشک کردن با شوک الکتریکی [58]

شکل 2-2-27 میکروفوتوگرافی الکترونی با وضوح پایین (A) و با وضوح بالا (B) از سطح تیتانیوم تحت عملیات با لیزر فمتوثانیه [27]
ما طیف گسترده ای از روشهای پوشش را برای ایجاد تشکیل برجستگی دو سطحی در نظر گرفته ایم. همه آنها با ترکیبی از روشها متحد هستند که باعث تشکیل برجستگی میکرون و نانومتری می شوند. این کار، ترکیبی از عملیات آندی و سندبلاست، اچینگ اسیدی و قلیایی، سنتز سل-ژل و خشک کردن با شوک الکتریکی، اچینگ اسیدی و کندوپاش کاتدی و غیره است. با این حال، در متون علمی روشی پیدا شد که برجستگی دو سطحی را همزمان فقط با یک روش ایجاد کرد. در مرجع ]27[، عملیات لیزر فمتوثانیه باعث تشکیل توده های میکرونی با زبری نانومتری از سطح بیرونی شد (شکل 2-2-27).
بنابراین، در حال حاضر روشهای زیادی از اصلاح سطح تیتانیوم وجود دارد که به ما این امکان را می دهد تا با ساختار سلسله مراتبی دو ترازه یک برجستگی را ایجاد کنیم. اکثریت نشریات روشهای مبتنی بر روشهای استاندارد سنتز را مورد بحث قرار می دهند: عملیات آندی ]59[، ترمواکسایش ]60[، اچینگ اسیدی ]61[، پردازش لیزر ]62[، سندبلاست ]63[ و غیره. علیرغم دشواری در ایجاد ساختارهای سلسله مراتبی دو ترازه که سطح پایینتر را در محدوده 1-1000 نانومتر و سطح بالایی را در محدوده 1-100 میکرون ترکیب می کنند، ولی از نظر تکنولوژی قابل حل هستند. بنابراین، باید نتیجه بگیریم که روش بهبود ایمپلنت زیست فعال استخوان نه تنها به دلیل افزایش خواص بیوپزشکی، بلکه به دلیل قابلیت پردازش روشهای مورد استفاده اصلاح سازی امیدوارکننده است.
2-2-4 کاربرد عملی پوشش با سلسله مراتبی دو ترازه
از سطح برجستگی در ایمپلنتولوژی
از لحاظ موضوعی، درست در سال 2016 ما دوازده مقاله را توصیف کردیم که روشهای جدید سنتز و خواص پوششهای زیست فعال را با یک سلسله مراتبی دو ترازه ]64-72، 58[نشان می دهند که به صراحت به توسعه فعال منطقه اشاره دارد. این موضوع را می توان با این واقعیت توضیح داد که ایمپلنت های موجود خیلی ایده آل نیستند. این امر همچنین در مورد خواص مکانیکی پایه های فلزی اینگونه صدق می کند: در جهت فعالیت کاری روی ایجاد آلیاژهای جدید ]73،74[، فلز بسیار ریز ]75،76[ و طراحی های ایمپلنت، کار روی ایجاد و استفاده از روشها در چندین دهه برای انتشار متوقف نشده است. این مسیر بسیار مهمی است اما باید توجه داشت که در زمینه های مختلف کاشت، مشکل اصلی خط اتصال بافتهای بیولوژیکی و ایمپلنت است: عدم پذیرش ]81[، عفونت منطقه پیش لانه گزینی ]82[، تغییر ساختار میدان پیش لانه گزینی در طول استخراج مداوم: بیماری پری ایمپلنت یا لثه ایمپلنت ]83[، جذب زیستی هیدروکسی آپاتیت ]84[، لیچینگ فلزات سمی از آلیاژهای تیتانیوم پزشکی ]85[ و غیره. حل این مشکلات غالباً به اصلاح سطح ایمپلنت ها نیاز دارد و امیدوارکننده ترین روشها ایجاد سلسله مراتبی دو ترازه از برجستگی است، زیرا چنین پوشش هایی همانطور که گفته شد جایگزینی پیوند را سرعت می بخشند. با تسریع این فرآیند، می توان احتمال پس زدن ایمپلنت و عفونت منطقه پیش لانه گزینی بیماری پری ایمپلنت را کاهش داد؛ این پوشش می تواند مسیر انتشار یونهای سمی را نیز مسدود کند. یک احتمال جالبتر از سطح توسعه یافته، انتقال ترکیبات مفید اضافی است: آنتی بیوتیک ها، پروموترهای فرآیند پیوند استخوانی مثل کلسیم فسفاتها، بیس فسفوناتها و غیره. بنابراین، باید نتیجه بگیریم که این منطقه با توجه به فرصت بهبودی خواص بیوپزشکی ایمپلنت ها و امکان تولید در سطح تجاری از این روشهای کاربردی، منطقه ای امیدوارکننده از ایمپلنتولوژی است.
2-2-5 نتیجه گیری
به طور خلاصه براساس ارزیابی ها، باید توجه داشته باشیم که تجربیات طولانی مدت پری ایمپلنت از کاربردهای ایمپلنت تیتانیومی استخوان، تأثیر قابل توجه تغییرات هندسی سطح روی خواص بیوپزشکی را نشان داد. این موضوع، اثرات برجستگی با اندازه میکرو و نانو در چنین فرآیندهایی همانند تمایز تسریع بخشیدن به استئوبلاستها، رسوب هیدروکسی آپاتیت بیولوژیکی در زبری نانومتری و مسدود کردن جریان آهسته استئوبلاستها در زبری هایی با اندازه میکرون می باشد. اما آثار به دست آمده در دهه های اخیر نشان می دهد که بهینه سازی، ترکیب دو نوع برجستگی در یک لایه سطحی از ایمپلنت است و اجازه ترکیبی از آثار ویژه برای هر نوعی را می دهد و یک اثر هم افزایی را به نمایش می گذارد. سلسله مراتبی دو ترازه یا همان دو سطحی باعث کاهش دوره علاج و بهبود چسبندگی بافت استخوان به ایمپلنت می شود. این امر به میزان قابل توجهی باعث بهبود کیفیت ایمپلنت ها از نظر راحتی و آسایش بیمار شده و در عین حال منجر به کاهش آمار آسیب بافت و حذف ایمپلنت خواهد شد. بیشترین آثار در این زمینه، کاربرد روشهای شناخته شده برای ایجاد سلسله مراتبی برجستگی دو ترازه را توصیف می کند که بیانگر احتمال اجرای عملی آنها است. بنابراین، می توان نتیجه گرفت که این نقطه یکی از مناطق امیدوارکننده در کاشت استخوان است.
References
[1] P.I. Bra°nemark, U. Breine, R. Adell, B.O. Hansson, J. Lindstr€om, A ° . Ohlsson, Intraosseous
anchorage of dental prostheses. I. Experimental studies, Scand. J. Plast. Reconstr.
Surg. 3 (2) (1969) 81–100.
[2] C.P.A.T. Klein, K. de Groot, Implant systems based on bioactive ceramics, Osseo-integr.
Impl. 2 (1990) 193–208.
[3] A.K. Mishra, J.A. Davidson, R.A. Poggie, P. Kovacs, T.J. FitzGerald, Mechanical and tribological
properties and biocompatibility of diffusion hardened Ti-13Nb-13Zr—a new
titanium alloy for surgical implants, in: Medical Applications of Titanium and Its Alloys:
The Material and Biological Issues, ASTM International, West Conshohocken,
Pennsylvania, 1996.
[4] K. Donath, M.D. Rohrer, J. Beck-Mannagetta, A histologic evaluation of a mandibular
cross section one year after augmentation with hydroxyapatite particles, Oral Surg Oral
Med Oral Pathol 63 (6) (1987) 651–655.
[5] J. Lincks, B.D. Boyan, C.R. Blanchard, C.H. Lohmann, Y. Liu, D.L. Cochran, Z. Schwartz,
Response of MG63 osteoblast-like cells to titanium and titanium alloy is dependent on surface
roughness and composition, Biomaterials 19 (23) (1998) 2219–2232.
[6] M.M. Shalabi, A. Gortemaker, M.A. Van’t Hof, J.A. Jansen, N.H.J. Creugers, Implant
surface roughness and bone healing: a systematic review, J. Dent. Res. 85 (6) (2006)
496–500.
[7] D.P. Oliveira, A. Palmieri, F. Carinci, C. Bolfarini, Gene expression of human osteoblasts
cells on chemically treated surfaces of Ti-6Al-4V-ELI, Mater. Sci. Eng. C 51 (1) (2015)
248–255.
[8] B.D. Boyan, R. Batzer, K. Kieswetter, Y. Liu, D.L. Cochran, S. Szmuckler-Moncler, et al.,
Titanium surface roughness alters responsiveness of MG63 osteoblast-like cells to 1a,
25-(OH) 2D3, J. Biomed. Mater. Res. 39 (1) (1998) 77–85.
140 Titanium in Medical and Dental Applications
[9] O. Zinger, K. Anselme, A. Denzer, P. Habersetzer, M. Wieland, J. Jeanfils, et al., Timedependent
morphology and adhesion of osteoblastic cells on titanium model surfaces featuring
scale-resolved topography, Biomaterials 25 (14) (2004) 2695–2711.
[10] J.I. Rosales-Leal, M.A. Rodrı´guez-Valverde, G. Mazzaglia, P.J. Ramon-Torregrosa,
L. Diaz-Rodriguez, O. Garcia-Martinez, et al., Effect of roughness, wettability and morphology
of engineered titanium surfaces on osteoblast-like cell adhesion, Colloids Surf.
A Physicochem. Eng. Asp. 365 (1) (2010) 222–229.
[11] T.P. Kunzler, T. Drobek, M. Schuler, N.D. Spencer, Systematic study of osteoblast and
fibroblast response to roughness by means of surface-morphology gradients,
Biomaterials 28 (2007) 2175–2182.
[12] M. Kim, M. Choi, C. Kim, Activation of phospholipase D1 by surface roughness of titanium
in MG63 osteoblast-like cell, Biomaterials 27 (2006) 5502–5511.
[13] J.Y. Martin, Z. Schwartz, T.W. Hummert, D.M. Schraub, J. Simpson, J. Lankford, et al.,
Effect of titanium surface roughness on proliferation, differentiation, and protein synthesis
of human osteoblast-like cells (MG63), J. Biomed. Mater. Res. 29 (3) (1995) 389–401.
[14] L. Marinucci, S. Balloni, E. Becchetti, S. Belcastro, M. Guerra, M. Calvitti, et al., Effect of
titanium surface roughness on human osteoblast proliferation and gene expression in vitro,
Int. J. Oral Maxillofac. Impl. 21 (5) (2006).
[15] R. Lange, F. L€uthen, U. Beck, J. Rychly, A. Baumann, B. Nebe, Cell-extracellular matrix
interaction and physico-chemical characteristics of titanium surfaces depend on the roughness
of the material, Biomol. Eng. 19 (2) (2002) 255–261.
[16] L. Le Guehennec, M.A. Lopez-Heredia, B. Enkel, P. Weiss, Y. Amouriq, P. Layrolle,
Osteoblastic cell behaviour on different titanium implant surfaces, Acta Biomater. 4 (3)
(2008) 535–543.
[17] E. Eisenbarth, P. Linez, V. Biehl, D. Velten, J. Breme, H.F. Hildebrand, Cell orientation
and cytoskeleton organisation on ground titanium surfaces, Biomol. Eng. 19 (2) (2002)
233–237.
[18] T.J. Webster, R.W. Siegel, R. Bizios, Osteoblast adhesion on nanophase ceramics,
Biomaterials 20 (13) (1999) 1221–1227.
[19] W. Zhang, Z. Li, Y. Liu, D. Ye, J. Li, L. Xu, X. Jiang, Biofunctionalization of a titanium
surface with a nano-sawtooth structure regulates the behavior of rat bone marrow mesenchymal
stem cells, Int. J. Nanomed. 7 (2012) 4459–4472.
[20] C. Yao, V. Perla, J.L. McKenzie, E.B. Slamovich, T.J. Webster, Anodized Ti and Ti-6Al-
4V possessing nanometer surface features enhances osteoblast adhesion, J. Biomed.
Nanotechnol. 1 (1) (2005) 68–73.
[21] L. Prodanov, E. Lamers, M. Domanski, R. Luttge, J.A. Jansen, X.F. Walboomers, The
effect of nanometric surface texture on bone contact to titanium implants in rabbit tibia,
Biomaterials 34 (12) (2013) 2920–2927.
[22] D. Buser, R.K. Schenk, S. Steinemann, J.P. Fiorellini, C.H. Fox, H. Stich, Influence of
surface characteristics on bone integration of titanium implants. A histomorphometric
study in miniature pigs, J. Biomed. Mater. Res. A 25 (7) (1991) 889–902.
[23] F. Schwarz, M. Herten, M. Sager, M. Wieland, M. Dard, J. Becker, Bone regeneration in
dehiscence-type defects at chemically modified (SLActive®) and conventional SLA titanium
implants: a pilot study in dogs, J. Clin. Periodontol. 34 (1) (2007) 78–86.
[24] J. Karlsson, R. Jimbo, H.M. Fathali, H.O. Schwartz-Filho, M. Hayashi, M. Halvarsson,
M. Andersson, In vivo biomechanical stability of osseointegrating mesoporous TiO2
implants, Acta Biomater. 8 (12) (2012) 4438–4446.
[25] X. Chen, K. Cai, M. Lai, L. Zhao, L. Tang, Mesenchymal stem cells differentiation on
hierarchically micro/Nano-structured titanium substrates, Adv. Eng. Mater. 14 (5)
(2012) B216–B223.
Modern techniques of surface geometry modification 141
[26] P. Jiang, J. Liang, C. Lin, Construction of micro-nano network structure on titanium surface
for improving bioactivity, Appl. Surf. Sci. 280 (2013) 373–380.
[27] J.R. Bush, B.K. Nayak, L.S. Nair, M.C. Gupta, C.T. Laurencin, Improved bio-implant
using ultrafast laser induced self-assembled nanotexture in titanium, J. Biomed. Mater.
Res. B Appl. Biomater. 97 (2) (2011) 299–305.
[28] L. Zhao, S. Mei, P.K. Chu, Y. Zhang, Z. Wu, The influence of hierarchical hybrid micro/
nano-textured titanium surface with titania nanotubes on osteoblast functions,
Biomaterials 31 (19) (2010) 5072–5082.
[29] T. Ueno, N. Tsukimura, M. Yamada, T. Ogawa, Enhanced bone-integration capability of
alkali-and heat-treated nanopolymorphic titanium in micro-to-nanoscale hierarchy,
Biomaterials 32 (30) (2011) 7297–7308.
[30] K. Kubo, N. Tsukimura, F. Iwasa, T. Ueno, L. Saruwatari, H. Aita, T. Ogawa, Cellular
behavior on TiO2 nanonodular structures in a micro-to-nanoscale hierarchy model,
Biomaterials 30 (29) (2009) 5319–5329.
[31] M.-J. Kim, M.-U. Choi, C.-W. Kim, Activation of phospholipase D1 by surface roughness
of titanium in MG63 osteoblast-like cell, Biomaterials 27 (2006) 5502–5511.
[32] Schmidt C., Kaspar D., Sarkar M.R., Claes L.E., Ignatius A.A. A scanning electron
microscopy study of human osteoblast morphology on five orthopedic metals. J. Biomed.
Mater. Res. 2002 V. 63 P. 252–261.
[33] Wennerberg A, Albrektsson T, Andersson B, Krol JJ. A histomorphometric and removal
torque study of screw-shaped titanium implants with three different surface topographies.
Clin. Oral Impl. Res. 1995 V. 6 P. 24–30.
[34] N.P. Lang, A.C. Wetzel, H. Stich, R.G. Caffesse, Histologic probe penetration in healthy
and inflamed peri-implant tissues, Clin. Oral Impl. 5 (1994) 191–201.
[35] M.M. Shalabi, A. Gortemaker, M.A. Van’t Hof, J.A. Jansen, N.H.J. Creugers, Implant surface
roughness and bone healing: a systematic review, J. Dent. Res. 85 (2006) 496–500.
[36] Lincks J., Boyan B.D., Blanchard C.R., Lohmann C.H., Liu Y., Cochran D.L., Dean D.D.,
Schwartz Z. Response of MG63 osteoblast-like cells to titanium and titanium alloy
is dependent on surface roughness and composition. Biomaterials 1998 V. 19 P.
2219–2232.
[37] Klokkevold P.R., Nishimura R.D., Adachi M., Caputo A. Osseointegration enhanced by
chemical etching of the titanium surface: a torque removal study in the rabbit. Clin. Oral
Impl. Res. 1997 V. 8 P. 442–447.
[38] Cho S.-A., Park K.-T. The removal torque of titanium screw inserted in rabbit tibia treated
by dual acid etching. Biomaterials 2003 V. 24 P. 3611–3617.
[39] Herrero-Climent M., Lazaro P., Vicente Rios J., Lluch S., Marques M., Guillem-Marti J.,
Gil F.J. Influence of acid-etching after grit-blasted on osseointegration of titanium
dental implants: in vitro and in vivo studies. J. Mater. Sci. Mater. Med. 2013 V. 24 P.
2047–2055.
[40] He F.M., Yang G.L., Li Y.N., Wang X.X., Zhao S.F. Early bone response to sandblasted,
dual acid-etched and H2O2/HCl treated titanium implants: an experimental study in the
rabbit. Int. J. Oral Maxillofac. Surg. 2009 V. 38 P. 677–681.
[41] Shi G.-S., Ren L.-F., Wang L.-Z., Lin H.-S., Wang S.-B., Tong Y.-Q. H2O2/HCl and heattreated
Ti-6Al-4V stimulates pre-osteoblast proliferation and differentiation. Oral Surg.
Oral Med. Oral Pathol. Oral Radiol. Endod. 2009 V. 108 N. 3 P. 368–375.
[42] Buser D., Janner S.F.M., Wittneben J.-G., Br€agger U., Ramseier C.A., Salvi G.E. 10-year
survival and success rates of 511 titanium implants with a sandblasted and acid-etched
surface: a retrospective study in 303 partially edentulous patients. Clin. Impl. Dent.
Rel. Res., 2012 V.14. I. 6. P. 839–851.
142 Titanium in Medical and Dental Applications
[43] D.V. Nazarov, E.G. Zemtsova, R.Z. Valiev, V.M. Smirnov, Formation of micro-and
nanostructures on the nanotitanium surface by chemical etching and deposition of titania
films by atomic layer deposition (ALD), Materials 8 (12) (2015), https://doi.org/10.3390/
ma80x000x.
[44] D.V. Nazarov, E.G. Zemtsova, A.Y. Solokhin, R.Z. Valiev, V.M. Smirnov, Modification
of the surface topography and composition of ultrafine and coarse grained titanium by
chemical etching, Nano 7 (2017) 15, https://doi.org/10.3390/nano7010015.
[45] Vetrone F., Variola F., Tambasco de Oliveira P., Zalzal S.F., Yi J.-H., Sam J., Bombonato-
Prado K.F., Sarkissian A., Perepichka D.F., Wuest J.D., Rosei F., Nanci A. Nanoscale oxidative
patterning of metallic surfaces to modulate cell activity and fate. Nano Lett.
2009 V. 9, No. 2 P. 659–665.
[46] Masahashi N., Mizukoshi Y., Semboshi S., Ohmura K., Hanada S. Photo-induced properties
of anodic oxide films on Ti-6Al-4V. Thin Solid Films 2012 V. 520 P. 4956–4964
[47] Chrzanowski W., Szewczenko J., Tyrlik-Held J., Marciniak J., Zak J. Influence of the
anodic oxidation on the physicochemical properties of the Ti-6Al-4V ELI alloy. J. Mater.
Process. Technol. 2005 V. 162–163 P. 163–168.
[48] Goudarzi M., Batmanghelich F., Afshar A., Dolati A., Mortazavi G. Development of electrophoretically
deposited hydroxyapatite coatings on anodized nanotubular TiO2 structures:
corrosion and sintering temperature. Appl. Surf. Sci. 2014 V. 301 P. 250–257.
[49] Zhao L., Mei S., Chu P.K., Zhang Y., Wu Z. The influence of hierarchical hybrid micro/
nano-textured titanium surface with titania nanotubes on osteoblast functions. Biomaterials
2010 V. 31 P. 5072–5082.
[50] C. Yao, E.B. Slamovich, T.J. Webster, Enhanced osteoblast functions on anodized titanium
with nanotube-like structures, J. Biomed. Mater. Res. A 85A (1) (2008) 157–166.
[51] Weingart D., Steinemann S., Schilli W., Strub J. R., Hellerich U., Assenmacher J.,
Simpson J.: Titanium deposition in regional lymph nodes after insertion of titanium screw
implants in maxillofacial region. Int. J. Oral Maxillofac. Surg. 1994 V. 23 P. 450–452.
[52] Motemani Y., Greulich C., Khare C., Lopian M., Buenconsejo P.J.S., Schildhauer T.A.,
Ludwig A., K€oller M. Adherence of human mesenchymal stem cells on Ti and TiO2
nano-columnar surfaces fabricated by glancing anglesputter deposition. Appl. Surf. Sci.
2014 V. 292 P. 626–631.
[53] Xue W., Liu X., Zheng X.B., Ding C. In vivo evaluation of plasma-sprayed titanium coating
after alkali modification. Biomaterials 2005 V. 26 P. 3029–3037.
[54] Piszczek P., Muchewicz Z˙ ., Radtke A., Gryglas M., Dahm H., Ro´z� ycki H. CVD of TiO2
and TiO2/Ag antimicrobial layers: deposition from the hexanuclear μ-oxo Ti(IV) complex
as a precursor, and the characterization. Surf. Coat. Technol. 2013 V. 222 P. 38–43.
[55] Takahashi Y., Matsuoka Y. Dip-coating of TiO2 films using a sol derived from Ti(O-i-
Pr)4-diethanolamine-H2O-i-PrOH system. J. Mater. Sci. 1988. V 23 P. 2259–2266.
[56] Areva S., Aaritalo V., Tuusa S., Jokinen M., Linden M., Peltola T. Sol-gel-derived TiO2-
SiO2 implant coatings for direct tissue attachment. Part II: evaluation of cell response.
J. Mater. Sci: Mater. Med. 2007 V. 18 P. 1633–1642.
[57] Y. Xie, H. Ao, S. Xin, X. Zheng, C. Ding, Enhanced cellular responses to titanium coating
with hierarchical hybrid structure, Mater. Sci. Eng. C 38 (2014) 272–277.
[58] E.G. Zemtsova, A.Y. Arbenin, R.Z. Valiev, E.V. Orekhov, V.G. Semenov, V.M. Smirnov,
Two-level micro-to-nanoscale hierarchical TiO2 nanolayers on titanium surface, Materials
9 (12) (2016) 1010.
[59] L. Lin, H. Wang, M. Ni, Y. Rui, T.Y. Cheng, C.K. Cheng, et al., Enhanced osteointegration
of medical titanium implant with surface modifications in micro/nanoscale structures,
J. Orthopaed. Transl. 2 (1) (2014) 35–42.
Modern techniques of surface geometry modification 143
[60] G. Wang, J. Li, K. Lv, W. Zhang, X. Ding, G. Yang, et al., Surface thermal oxidation on
titanium implants to enhance osteogenic activity and in vivo osseointegration, Sci. Rep.
6 (2016) 1–13.
[61] S.F. Lamolle, M. Monjo, M. Rubert, H.J. Haugen, S.P. Lyngstadaas, J.E. Ellingsen, The
effect of hydrofluoric acid treatment of titanium surface on nanostructural and chemical
changes and the growth of MC3T3-E1 cells, Biomaterials 30 (5) (2009) 736–742.
[62] G. Wang, J. Li, K. Lv, W. Zhang, X. Ding, G. Yang, et al., Surface thermal oxidation on
titanium implants to enhance osteogenic activity and in vivo osseointegration, Sci. Rep.
6 (2016).
[63] Y. Li, S. Zou, D. Wang, G. Feng, C. Bao, J. Hu, The effect of hydrofluoric acid treatment
on titanium implant osseointegration in ovariectomized rats, Biomaterials 31 (12) (2010)
3266–3273.
[64] I.H. Kim, J.S. Son, S.H. Choi, K.H. Kim, T.Y. Kwon, Nano-and micro-scale oxidative
patterning of titanium implant surfaces for improved surface wettability, J. Nanosci.
Nanotechnol. 16 (2) (2016) 1883–1886.
[65] J.Y. Xu, X.S. Chen, C.Y. Zhang, Y. Liu, J. Wang, F.L. Deng, Improved bioactivity of
selective laser melting titanium: Surface modification with micro-/nano-textured hierarchical
topography and bone regeneration performance evaluation, Mater. Sci. Eng. C
68 (2016) 229–240.
[66] C. Yin, Y. Zhang, Q. Cai, B. Li, H. Yang, H. Wang, et al., Effects of the micro-nano surface
topography of titanium alloy on the biological responses of osteoblast, J. Biomed.
Mater. Res. A 105 (3) (2016) 757–769.
[67] S.L. Hyzy, A. Cheng, D.J. Cohen, G. Yatzkaier, A.J. Whitehead, R.M. Clohessy, et al.,
Novel hydrophilic nanostructured microtexture on direct metal laser sintered Ti-6Al-
4V surfaces enhances osteoblast response in vitro and osseointegration in a rabbit model,
J. Biomed. Mater. Res. A 104 (8) (2016) 2086–2098.
[68] P. Yu, X. Zhu, X. Wang, S. Wang, W. Li, G. Tan, et al., Periodic nanoneedle and buffer
zones constructed on a titanium surface promote osteogenic differentiation and bone calcification
in vivo, Adv. Healthc. Mater. 5 (3) (2016) 364–372.
[69] D. Kuczy�nska, P. Kwa�sniak, J. Marczak, J. Bonarski, J. Smolik, H. Garbacz, Laser surface
treatment and the resultant hierarchical topography of Ti grade 2 for biomedical application,
Appl. Surf. Sci. 390 (2016) 560–569.
[70] G. Li, H. Cao, W. Zhang, X. Ding, G. Yang, Y. Qiao, et al., Enhanced osseointegration of
hierarchical micro/Nanotopographic titanium fabricated by microarc oxidation and electrochemical
treatment, ACS Appl. Mater. Interfaces 8 (6) (2016) 3840–3852.
[71] F.A. Shah, M.L. Johansson, O. Omar, H. Simonsson, A. Palmquist, P. Thomsen, Lasermodified
surface enhances osseointegration and biomechanical anchorage of commercially
pure titanium implants for bone-anchored hearing systems, PLoS One 11 (6)
(2016), e0157504.
[72] Q. Fu, A. Bellare, Y. Cui, B. Cheng, S. Xu, L. Kong, The effect of hierarchical micro/
nanotextured titanium implants on osseointegration immediately after tooth extraction
in beagle dogs, Clin. Impl. Dentist. Rel. Res. (2016).
[73] X. Meng, X. Wang, Y. Guo, S. Ma, W. Luo, X. Xiang, et al., Biocompatibility evaluation
of a newly developed Ti-Nb-Zr-Ta-Si alloy implant, J. Biomater. Tissue Eng. 6 (11)
(2016) 861–869.
[74] K. Hagihara, T. Nakano, H. Maki, Y. Umakoshi, M. Niinomi, Isotropic plasticity of β-type
Ti-29Nb-13Ta-4.6Zr alloy single crystals for the development of single crystalline β-Ti
implants, Sci. Rep. 6 (2016) 1–10.
144 Titanium in Medical and Dental Applications
[75] I.P. Semenova, G.V. Klevtsov, N.Y.A. Klevtsova, G.S. Dyakonov, A.A. Matchin,
R.Z. Valiev, Nanostructured titanium for maxillofacial mini-implants, Adv. Eng. Mater
18 (7) (2016) 1216–1224.
[76] B. An, Z. Li, X. Diao, H. Xin, Q. Zhang, X. Jia, et al., In vitro and in vivo studies of
ultrafine-grain Ti as dental implant material processed by ECAP, Mater. Sci. Eng. C
67 (2016) 34–41.
[77] A. Blum, J.B. Meyer, A. Raymond, M. Louis, O. Bakour, R. Kechidi, et al., CT of hip
prosthesis: new techniques and new paradigms, Diagnos. Intervent. Imaging 97 (7)
(2016) 725–733.
[78] S.S. Porter, Platform switching: a new concept in implant dentistry for controlling postrestorative
crestal bone levels, Dent 26 (2006) 9–17.
[79] H. Wehrbein, J. Glatzmaier, U. Mundwiller, P. Diedrich, The orthosystem—a new implant
system for orthodontic anchorage in the palate, J. Orofac. Orthoped. Fortschr.
Kieferorthopad.: Organ/Off. J. Deutsche Gesellsch. Kieferorthopad. 57 (3) (1996)
142–153.
[80] J.S. Hirschhorn, A.A. McBeath, M.R. Dustoor, Porous titanium surgical implant materials,
J. Biomed. Mater. Res. 5 (6) (1971) 49–67.
[81] R.J. Weyant, Characteristics associated with the loss and peri-implant tissue health of endosseous
dental implants, Int. J. Oral Maxillofac. Impl 9 (1) (1994) 95–102.
[82] H. Tsuchiya, T. Shirai, H. Nishida, H. Murakami, T. Kabata, N. Yamamoto, et al., Innovative
antimicrobial coating of titanium implants with iodine, J. Orthop. Sci. 17 (5) (2012)
595–604.
[83] T. Albrektsson, B. Chrcanovic, P.O. €Ostman, L. Sennerby, Initial and long-term crestal
bone responses to modern dental implants, Periodontology 73 (1) (2017) 41–50.
[84] S. Wenisch, J.P. Stahl, U. Horas, C. Heiss, O. Kilian, K. Trinkaus, et al., In vivo mechanisms
of hydroxyapatite ceramic degradation by osteoclasts: fine structural microscopy,
J. Biomed. Mater. Res. A 67 (3) (2003) 713–718.
[85] N.J. Hallab, S. Anderson, M. Caicedo, A. Brasher, K. Mikecz, J.J. Jacobs, Effects of soluble
metals on human peri-implant cells, J. Biomed. Mater. Res. A 74 (1) (2005) 124–140.
Modern techniques of surface geometry modification 145