2-1-1 تقاضای بالینی و هدف از اصلاح سطح
2-1-1-1 هدف اصلاح سطح پاسخگویی به تقاضای بالینی
بسیاری از تجهیزات پزشکی متشکل از فلزات به وسیله سرامیکها و پلیمرها جایگزین شده اند، زیرا خواص آنها با پیشرفت تکنولوژی در طول چهار دهه گذشته بسیار بهبود یافته است. با این حال، بیش از 70% از دستگاه های ارتوپدی به دلیل استحکام، دوام و چقرمگی بالا هنوز هم از فلزات ساخته می شوند. بخصوص، تیتانیوم و آلیاژهای آن که به دلیل مقاومت در برابر خوردگی عالی و سازگاری خوب با بافت بدن به عنوان مواد ایمپلنت پزشکی و دندانپزشکی مورد استفاده قرار می گیرند. اما با توجه به اینکه دستگاه های ایمپلنت ساخته شده از فلزات به طور معمول مواد مصنوعی هستند، بنابراین زیست سازگاری کمتری را از خود نشان می دهند و هیچگونه عملکرد بیولوژیکی ندارند. برای بهبود زیست سازگاری و افزودن عملکرد بیولوژیکی به فلزات، عملیات سطح یا اصلاح سطح ضروری است. زیرا زیست سازگاری و عملکرد بیولوژیکی را نمی توان در طی فرآیندهای تولید فلزات مثل ذوب، ریخته گری، فورجینگ و عملیات حرارتی اضافه کرد. شرایط اصلاح سطح شامل عملیات سطح است، در حالیکه اصلاح سطح دسته ای از عملیات سطح در رشته مهندسی سطح می باشد. اصلاح سطح، ترکیب سطح، ساختار و مورفولوژی سطح را تغییر می دهد و خواص مکانیکی بالک ماده را دست نخورده همانند شکل 2-1-1حفظ می کند. با اصلاح سطح، زیست سازگاری لایه سطح را می توان بهبود بخشید و عملکرد بیولوژیکی را می توان اضافه کرد. هدف اصلاح سطح، دستگاه های تارگت و خدمات در جدول 2-1-1 خلاصه شده است.
2-1-1-2 تشکیل استخوان و پیوند استخوان
این موضوع کاملاً مشخص است که تیتانیوم دارای سازگاری با بافت سخت یا خواص رسانش استخوانی می باشد. سازگاری با بافت سخت براساس واکنش سطحی بین تیتانیوم و بافت سخت ظاهر می شود. در این راستا "فرآیند پیوند استخوانی" اولین تعریف از پدیده بین تیتانیوم و بافت زنده است. تعریف دقیق برای پیوند بافت استخوانی: ایجاد یک رابط مستقیم بین ایمپلنت و استخوان بدون دخالت در بافت نرم است. بدون بافت اسکار (یا همان جای زخم)، غضروف یا الیاف های لیگامان بین استخوان و سطح ایمپلنت وجود ندارد. تماس مستقیم سطح ایمپلنت و استخوان را می توان از نظر میکروسکوپی ارزیابی کرد ]1[. مفهوم "فرآیند پیوند استخوانی" به طور طبیعی توسط دندانپزشکان و محققان پذیرفته شده تا مزیت زیست سازگاری تیتانیوم در میان فلزات را توضیح دهد. از این رو، تیتانیوم بخش عمده ای را در ایمپلنت های دندانی به خود اختصاص می دهد. پس از اینکه به مفهوم فرآیند پیوند استخوانی نفوذ شد، مطالعاتی برای آشکار شدن مکانیزم فرآیند پیوند استخوانی، به ویژه برای ارزیابی ساختار میکرو رابط بین تیتانیوم و بافت استخوان به صورت فعال انجام شد.
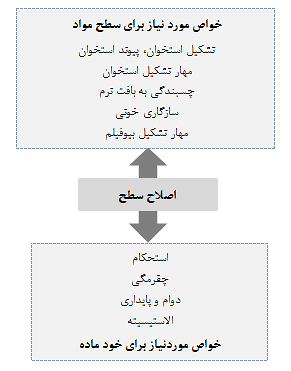
شکل 2-1-1 اصلاح سطح با افزودن خواص هدف به ماده به منظور حفظ شایستگی های خود ماده
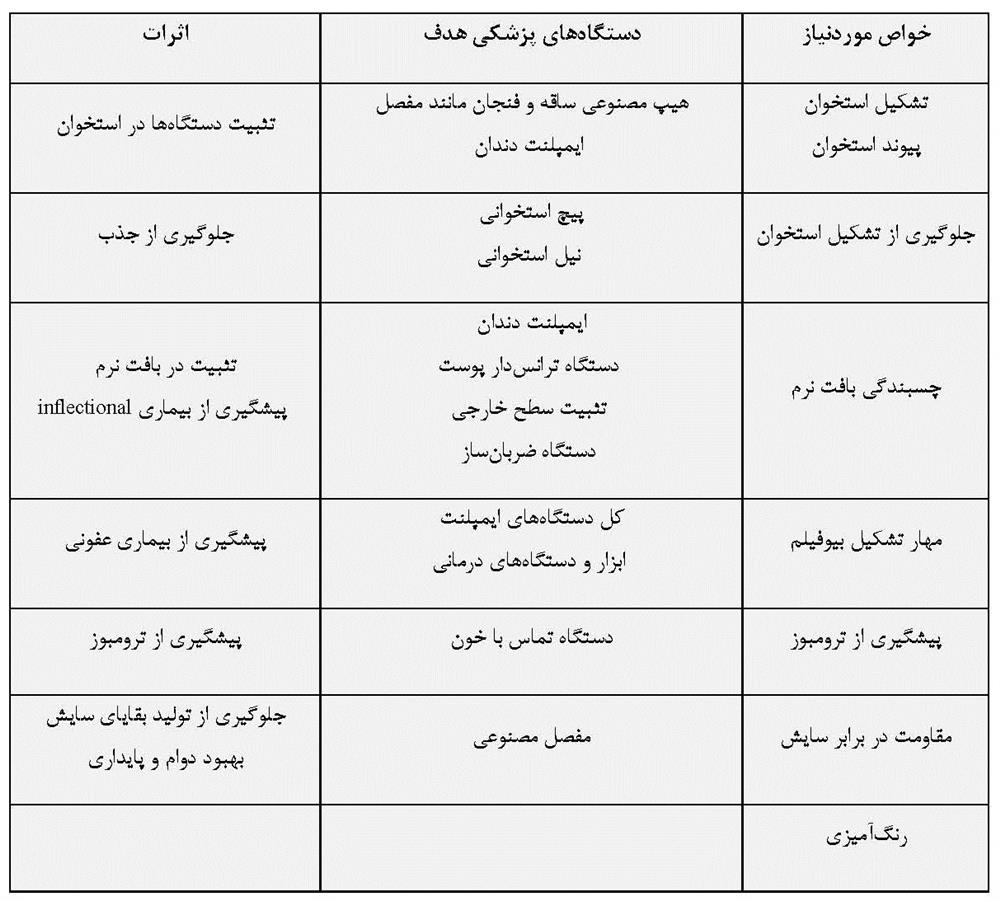
جدول 2-1-1 تقاضای فلزات برای تجهیزات پزشکی
تیتانیوم و آلیاژهای آن برای ایمپلنت های دندانی، مفاصل هیپ مصنوعی و فیکساتورهای استخوانی همانطور که در شکل 2-1-2 نشان داده شده مورد استفاده قرار می گیرند. با این حال، توانایی تشکیل استخوان برای اینها نسبت به سرامیک های زیست فعال مانند هیدروکسی آپاتیت و شیشه های زیست فعال کمتر می باشد. بنابراین، مطالعات بی شماری درباره روشهای اصلاح سطح به منظور بهبود سازگاری با بافت سخت تیتانیوم و آلیاژهای آن انجام شده و حتی تعدادی از آنها تجاری هم شده اند. در ساقه مفاصل هیپ مصنوعی و ایمپلنت های دندانپزشکی، نمی توان پیوند شیمیایی بین سطح فلز با بافت استخوان را انتظار داشت، همانطور که در شکل 2-1-3 نشان داده شده است. به عبارت دیگر، برای فلزات (به عنوان مواد مصنوعی معمولی) پیوند شیمیایی و طبیعی با استخوان به عنوان بافت زنده بخصوص در بدن انسانهایی با مایعات زیاد غیر ممکن است. بنابراین، اصلاح سطح برای تسریع در تشکیل استخوان و پیوند استخوان روی تیتانیوم و آلیاژهای آن ضروری است.
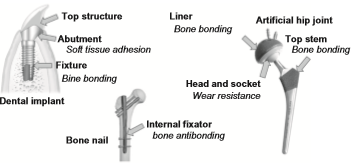
شکل 2-1-2 تجهیزات پزشکی متشکل از تیتانیوم و آلیاژهای آن و خواص سطحی موردنیاز برای تقاضاهای بالینی
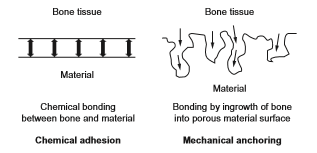
شکل 2-1-3 چگونگی پیوند بین بافت استخوان و مواد
2-1-1-3 جلوگیری از تشکیل استخوان
هنگامی که یک آلیاژ تیتانیوم با استفاده از جراحی در داخل استخوان انسان ایمپلنت می شود، یک لایه کلسیم فسفات به طور خودبخودی روی سطح آن شکل می گیرد. این توانایی درباره آلیاژ تیتانیوم برای تشکیل کلسیم فسفات، یکی از دلایل سازگاری بهتر با بافت سخت نسبت به سایر فلزات است؛ همچنین تشکیل استخوان را داخل بدن انسان تسریع می بخشد. با این حال، این توانایی می تواند هنگام برداشتن آلیاژ از استخوان عوارض بحرانی ایجاد کند. هنگامی که آلیاژهای تیتانیوم برای فیکساتورهای استخوان مانند: پیچ های استخوانی و نیلهای داخل استخوانی استفاده می شود، آنگاه استخوان جدیدی را روی آنها تشکیل می دهند و گاهی اوقات با استخوان اصلی (فرآیند پیوند استخوانی) ترکیب می شوند ]2-4[. بنابراین، با برداشتن فیکساتورها پس از ترمیم استخوان امکان شکستگی استخوان وجود دارد ]5-9[. بیمارانی که دچار شکستگی مجدد می شوند باید با برخی مشکلات که در اولین مرحله درمان وجود نداشت، عقبنشینی کنند. اگرچه فولاد زنگ نزن با آلیاژهای تیتانیوم از نظر استحکام و مقاومت در برابر خوردگی برابری نمی کند، اما برای جلوگیری از این مشکل استفاده شده است؛ همچنین شکستگی مجدد در طول بیرون کشیدن میله های فولادی زنگ نزن نیز گزارش شده است ]10[. بنابراین، عملیات های سطحی که منجر به تشکیل استخوان نمی شوند، برای استفاده ایمن از آلیاژهای تیتانیوم ضروری هستند. روش های عملیات سطحی برای مهار تشکیل استخوان در نزدیکی آلیاژهای تیتانیوم به ندرت مورد ارزیابی و مطالعه قرار گرفته است.
2-1-1-4 چسبندگی بافت نرم
چسبندگی بافت نرم، ویژگی مهمی در پیشگیری از بیماری inflectional است. ایمپلنت به دلیل التهاب ناشی از تهاجم باکتریایی به طور گسترده ای به عنوان علت عدم موفقیت در ایمپلنت های دندانی شناخته می شود ]11[. با استفاده از تهاجم باکتریایی می توان از چسبندگی کامل پیوندگاه اپیتلیوم به قسمت اباتمنت از ایمپلنت بدن جلوگیری کرد (شکل 2-1-4). در یک لنگر ایمپلنت در ارتودنسی، پیچ های ایمپلنت از لثه رد می شوند. اگر لثه به لنگر ایمپلنت نچسبد، ممکن است باکتری به رابط بین استخوان فک و ایمپلنت حمله کند و باعث التهاب شود. همچنین در فیکساتور خارجی در ارتوپدی، پیچ ها از پوست رد می شوند. بنابراین پوست باید به پیچ بچسبد و برای این کار یک دستگاه مؤثر در زیر پوست لازم است. این دستگاهها از تیتانیوم و آلیاژهای آن تشکیل شده اند. چسبندگی ضعیف بافت نرم به تیتانیوم و آلیاژهای آن می تواند باعث تهاجم باکتریایی، التهاب و در نهایت تغییر بیماری شود. بنابراین، نیاز به عملیات های سطحی تیتانیوم و آلیاژهای آن که به بافت نرم چسبیده اند، الزامی است.
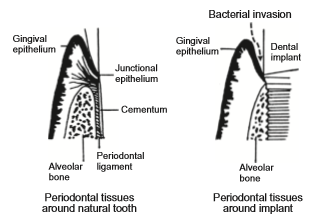
شکل 2-1-4 بافت های پریودنتال در نزدیکی دندان طبیعی و ایمپلنت دندان
2-1-1-5 جلوگیری از تشکیل بیوفیلم
در سیستم ایمپلنت دندان، باکتری ممکن است بعد از عمل جراحی نیز به موقعیتهای ایمپلنت شده حمله کند (شکل 2-1-5)، و باعث ایجاد عفونتهایی مانند پری ایمپلنت شود ]12-14[. این عفونتها نه تنها در ایمپلنت دندان بلکه در جراحی های ارتوپدی مانند ابزارآلات ستون فقرات نیز یک مسئله جدی به شمار می رود ]15[. پاتوژن های مقاوم مانند استافیلوکوک اورئوس مقاوم به متیسیلین باعث عفونت می شوند. این عفونت به ویژه در بیمارانی که پروتز لگن یا دستگاههای نخاعی یا ستون فقراتی ایمپلنت شده دارند، زیاد است ]16-17[. بیوفیلم به دلیل عوامل متعدد از طریق یک فرآیند پیچیده شکل می گیرد؛ چسبندگی باکتری اولیه به سطح و به دنبال آن ارتباط متقابل در بین باکتریها منجر به تشکیل یک باکتری چندلایه ای می شود ]18[. پس از تشکیل بیوفیلم، حذف کردن پاتوژنهای گلوکان جاسازی شده با توجه به محافظت از طریق ضد عفونی کننده ها بسیار دشوار است. بنابراین، مهار سطح از طریق چسبندگی باکتری و کمک به از بین بردن باکتری مورد نیاز است. مهار جذب پروتئین مؤثرترین روش برای مهار تشکیل بیوفیلم است، زیرا جذب پروتئین معمولاً فرآیند اولیه تشکیل بیوفیلم روی سطوح ایمپلنت می باشد.

شکل 2-1-5 ترکیب فیلم اکسید سطح (پسیو) روی تیتانیوم
2-1-1-6 پیشگیری از ترومبوز
تقاضای فلزات برای دستگاه های تماس با خون همیشه زیاد است. این فلزات معمولاً به دلیل خواص مکانیکی عالی، برای دستگاه های درون عروقی طولانی مدت مانند پمپ های خون، دریچه های قلبی، پیس میکر؛ و همچنین برای دستگاه های درون عروقی موقت مانند گاید وایرها و کانترها استفاده می شوند. در فلزات برای دستگاه های درون عروقی، سازگاری خون نیز اهمیت دارد. جذب پروتئین و چسبندگی پلاکتها به یک فلز واکنش های مهمی را برای شکل گیری ترومبوز روی فلز و کنترل سازگاری خون از فلز به دنبال دارد. جذب پروتئینها به سطح فلز بلافاصله پس از تماس فلز با خون اتفاق می افتد و سپس پلاکتها به سطح می چسبند. از آنجایی که فلزات معمولی غیر قیمتی معمولاً به وسیله فیلم های اکسید سطح پوشش داده می شوند، در نتیجه فیلم های اکسیدی نقش مهمی در برابر جذب پروتئین و چسبندگی پلاکتها به آنها به همراه دارند. از طرف دیگر، رابطه بین آنها و رفتار چسبندگی پلاکتها روی فلزات ناشناخته باقی مانده است. سطح چسبندگی پلاکت روی هر فلز پس از غوطه وری در یک محلول پلاسمای غنی از پلاکت به این ترتیب خلاصه می شود: فولاد زنگ نزن< آلیاژ Co-Cr-Mo < آلیاژ Ti-6Al-4V < آلیاژ Ti-6Al-7Nb < آلیاژ Ti-Nb = Ti ]19[. مهار چسبندگی پلاکت روی فولاد زنگ نزن و آلیاژ Co-Cr-Mo پوشش یافته با تشکیل فیلم اکسید سطح پسیو حاوی Cr2O3 انجام می شود، در حالیکه روی تیتانیوم و آلیاژهای آن که به وسیله فیلم حاوی TiO2 پوشش یافته، این مهار سریعتر خواهد بود. فیلم اکسید حاوی Cr2O3 دارای ثابت دی الکتریک کمتری نسبت به فیلم حاوی TiO2 است؛ نیروی الکترواستاتیک بزرگتری نسبت به دومی دارد؛ آلبومین های بیشتری را جذب می کند؛ که به عنوان پروتئینهای بازدارنده فعالیت دارند؛ و در نهایت تجمع پلاکتها را مهار می کند. بنابراین، چسبندگی و تجمع پلاکت روی تیتانیوم و آلیاژهای آن باید با اصلاح سطح کنترل شود تا مانع از جذب پروتئینها گردد.
2-1-1-7 افزایش مقاومت به سایش
سایش اصطکاکی جدیترین مشکل قطعات لغزشی در تجهیزات پزشکی یا مفاصل مصنوعی است. محبوبترین ترکیب قطعات لغزشی شامل یک آلیاژ کبالت-کروم- مولیبدن (Co-Cr-Mo) و پلی اتیلن با وزن مولکولی فوق العاده بالا است. سایش شدید، انسداد لغزش نرم در مفاصل را معرفی می کند. علاوه بر این، باقیمانده سایش باعث ساییدگی (یا استئولیز) استخوان ران می شود. به منظور کاهش خرده ریزهای سایش ناشی از فلزات که مشکلی غالب است، باید سطح آن کاملاً سخت شود. مقاومت به سایش آلیاژهای تیتانیوم کم است؛ بنابراین نمی توان از آنها برای کاربردهای سر استخوان استفاده کرد. مقاومت به سایش از طریق پوشش لایه های سخت مانند TiN و DLC (کربن الماسی شکل) و کاشتن یون نیتروژن با آلیاژ تیتانیوم انجام می شود. با این حال، این روش ها هنوز تجاری نشده اند. در حال حاضر، تیتانیوم و آلیاژهای آن با مقاومت به سایش مناسب در دسترس نیستند، بنابراین آلیاژهای Co-Cr-Mo به عنوان قطعات لغزشی استفاده می شوند.
2-1-1-8 رنگ آمیزی
رنگ آمیزی تیتانیوم و آلیاژهای آن از طریق آندایزینگ انجام می شود. رنگ آمیزی اغلب در سطح نهایی محصولات بخصوص برای تجهیزات پزشکی استفاده می شود. رنگ آمیزی سطح اجزای دستگاه ها امکان شناسایی آسان دستگاه ها و قطعات را فراهم می آورد. این مزیت در کاربردهای جراحی بسیار عالی است. آندایزینگ فرآیندی است که ضخامت اکسید سطوح فلزی را کنترل و تنظیم می کند. این تنظیم طیف نور را تغییر می دهد و در نتیجه رنگ قابل درک خواهد بود. با کنترل دقیق ضخامت اکسید سطح، طیف گسترده ای از رنگها را می توان تولید کرد. در تجهیزات دندانپزشکی و پزشکی، کدگذاری رنگ برای اندازه گیری، امکان شناسایی فوری قطعات موردنظر را هنگامی که زمان و دقت بسیار پر اهمیت است، فراهم می آورد. به منظور افزایش دقت و کارایی در حین جراحی می توان دستگاه های ایمپلنت، ابزارهای پزشکی و اجزای دستگاه ها را با رنگهای خاص یا استاندارد کدگذاری کرد.
2-1-2 سطح تیتانیوم
2-1-2-1 فیلم پسیو
به غیر از محیطهای کاهشی، فیلم واکنش روی فلزات همیشه با فرآیند خوردگی تشکیل می شود. فیلم پسیو مانند فیلم واکنشی است و از اهمیت ویژه ای برای محافظت در برابر خوردگی برخوردار است. هنگامی که حلالیت فیلم بسیار کم و هیچ منافذی وجود نداشته باشد، چسبندگی فیلم به زیرلایه سخت تر خواهد شد. این فیلم سپس در برابر خوردگی مقاوم یا به یک فیلم پسیو تبدیل می شود. فیلم پسیو شفاف و ضخامت چند نانومتری دارد. از آنجا که نرخ شکل گیری بسیار سریع است، فیلم پسیو به سرعت آمورف می شود. به عنوان مثال، فیلم اکسیدی روی زیرلایه فلزی تیتانیوم در 30 میلی ثانیه تولید می شود ]20[. به دلیل عدم وجود مرزدانه و عیوب ساختاری در فیلم های آمورف، آنها از مقاومت در برابر خوردگی برخوردار هستند. با این حال، در صورت افزایش بلورینگی فیلم، مقاومت به خوردگی فیلم کاهش می یابد. خوشبختانه، فیلم های پسیو حاوی مولکولهای آب هستند که باعث تقویت و حفظ حالت آمورف می شوند. هنگامی که تیتانیوم در آب دی یونیزه شده جلا می یابد و بلافاصله با استفاده از طیف سنجی فوتوالکترون اشعه ایکس آنالیز می شود، پیک منطقه انرژی الکترون Ti 2p به دست آمده از تیتانیوم به ترتیب منشأ گرفته از چهار نوع ظرفیت شیمیایی Ti0، Ti2+، Ti3+ و Ti4+ می باشد. اکسید سطح حاوی گروه هیدروکسید یا هیدروکسیل (OH-) و آب است ]21-22[. فیلم سطح روی تیتانیوم عمدتاً از TiO2 فاقد موازنه شیمیایی یا کم کریستالی تشکیل شده (شکل 2-1-5) و این فیلم در برابر یونهای کلرید محافظت می شود.
2-1-2-2 گروههای هیدروکسیل سطح
سطح اکسید با رطوبت هوا واکنش نشان می دهد و گروه های هیدروکسیل به سرعت تشکیل می شوند. در مورد تیتانیوم، اکسید سطح نه تنها با مولکولهای آب در محلولهای آبی بلکه با رطوبت موجود در هوا بلافاصله واکنش نشان می دهد و توسط گروه های هیدروکسیل ]23-24[ پوشانده می شوند، همانطور که در شکل A2-1-6 نشان داده شده است. گروه های هیدروکسیل سطح شامل ترمینال OH و پل OH به مقدار مساوی هستند.
گروههای هیدروکسیل سطحی فعال روی فیلم اکسیدی در محلول های آبی جدا شده و بارهای الکتریکی را تشکیل می دهند که در شکل B2-1-6 نشان داده شده است ]23-25[. بار مثبت یا منفی به دلیل تفکیک با مقدار pH محیط محلول آبی کنترل می شود: بارهای مثبت و منفی با pH معین در جایی که بار ظاهری صفر است، متعادل می شود. این pH نقطه صفر الکتریکی (pzc) است. pzc مقدار منحصر به فردی برای یک اکسید و یک شاخص است که سطح اکسید خاصیت اصلی یا اسیدی را نشان می دهد. به عنوان مثال، در مورد TiO2، pzc روتایل 5.3 و آناتاز 6.2 است ]23[. به عبارت دیگر، سطح آناتاز با pH کوچکتر اسیدی و با pH بزرگتر از 6.2 اساسی است. گروه های هیدروکسیل سطح فعال و بارهای الکتریکی تشکیل شده نقش مهمی برای عدم تحرک مولکولها دارند. بنابراین، غلظت گروه هیدروکسیل سطح روی اکسید و pH محیط محلول، عامل مهمی برای عدم تحرک مولکولها است.
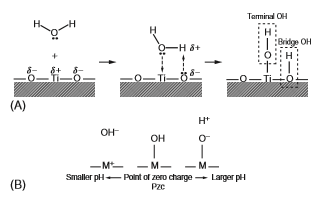
شکل 2-1-6 فرآیند تشکیل گروه هیدروکسیل روی اکسید تیتانیوم (A)
و تفکیک گروه هیدروکسیل در محلول آبی نقطه صفر الکتریکی (pzc) (B)
2-1-2-3 تشکیل کلسیم فسفات روی تیتانیوم
ترکیب فیلم اکسید سطحی مطابق با تغییرات محیط متفاوت است، در حالیکه این فیلم از لحاظ ماکروسکوپی پایدار می باشد. سطوح پسیو در تماس نزدیک با الکترولیت ها وجود دارد و انحلال جزئی و بارش مجدد سطح به طور مدوام از نظر میکروسکوپی اتفاق می افتد. با این مفهوم که ترکیب سطح همیشه مطابق با محیط در حال تغییر است.
کلسیم فسفات روی تیتانیوم و آلیاژهای آن توسط غوطه وری در محلول هنکس و سایر محلول ها روی تیتانیوم و آلیاژهای آن شکل می گیرد ]26-29[. این پدیده همچنین در کشت سلولی نیز مشاهده می شود ]29[. پدیده فوق ویژگی تیتانیوم و آلیاژهای آن می باشد ]27[. خواص ایمپلنتهای دندانی که برگرفته از استخوان فک انسان می باشد، همچنین شکل کلسیم فسفات و گوگرد روی سطوح را آشکار می سازد ]30-31[. فیلم اکسید سطح روی تیتانیوم کاملاً اکسیدی نشده و کمی واکنش پذیر است، در حالی که روی زیرکونیوم نسبتاً پایدار می باشد. همچنین فیلم روی زیرکونیوم نسبت به تیتانیوم پسیوتر و ایمن تر است. نه کلسیم و نه فسفات به تنهایی روی تیتانیوم وجود ندارند؛ بلکه کلسیم فسفات پسیو و ایمن در محیط های بیولوژیکی روی تیتانیوم تشکیل می شوند. از طرف دیگر، کلسیم هرگز روی زیرکونیوم جای داده نمی شود و زیرکونیوم فسفات تشکیل می شود. زیرکونیوم فسفات تشکیل شده روی زیرکونیوم بسیار پایدار است و لایه ای محافظ ایجاد می کند. بنابراین، کلسیم با لایه واکنش نشان نمی دهد ]32[. قابلیت شکل گیری کلسیم فسفات در تیتانیوم، زیرکونیوم، تانتالیوم و نیوبیوم ارزیابی می شود ]33[.
2-1-2-4 اهمیت جذب پروتئین به تیتانیوم
هنگامی که یک فلز وارد بدن انسان می شود و با بافت زنده تماس برقرار می کند، آنگاه پروتئین ها بلافاصله به سطح فلز جذب می شوند. جذب پروتئین ها بر چسبندگی سلولها به سطح تأثیر می گذارند. دناتوره شدن و تکه تکه شدن پروتئین جذب شده ممکن است عملکرد بدن میزبان را تحت تأثیر قرار دهد (شکل 2-1-7). برای توصیف پروتئین های جذب شده به فلزات و اکسیدهای فلزی می توان از روشهای مختلفی استفاده کرد ]34[، به ویژه روش الیپسومتری ]35[. برای پیشبینی جذب پروتئین، از اندازه گیری ترشوندگی در جایی استفاده می شود که قطرات مایع روی فلز اعمال می شود. فیبرینوژن روی سطح تیتانیوم نسبت به سطح طلا بسیار طبیعی تر جذب می شود ]36[، زیرا ضریب دی الکتریک عامل حاکم بر نیروی الکترواستاتیک، TiO2 80.1 و شبیه به آب است. بنابراین، فیبرینوژن ترکیب خود را حتی پس از جذب بر روی سطح تیتانیوم حفظ می کند.
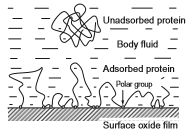
شکل 2-1-7 مدل احتمالی جذب پروتئین توسط فیلم اکسید سطحی روی تیتانیوم
2-1-2-5 مکانیزم سازگاری بافت سخت در تیتانیوم
تیتانیوم و آلیاژهای آن به عنوان بهترین مواد زیست سازگار شناخته شده و با موفقیت در ایمپلنت های دندانی و ارتوپدی استفاده می شوند. چرا تیتانیوم و آلیاژهای آن در مقایسه با آلیاژهای دیگر چنین زیست سازگاری خوبی را نشان می دهند؟ به طور کلی اعتقاد بر این است که تیتانیوم در محلولهای آبی و هوا منفعل می شود و این فیلم پسیو حتی در بدن انسان نیز پایدار است. بنابراین، ابتدا ثابت شد که تیتانیوم به دلیل مقاومت عالی در برابر خوردگی، سازگاری مناسبی با بافت سخت دارد. اما حالا مشخص شده که این فرضیه غلط است. آبکاری پلاتین روی تیتانیوم باعث شکل گیری استخوان روی خودش می شود، در حالیکه مقاومت در برابر خوردگی افزایش می یابد ]37[. بنابراین، سازگاری مناسب تیتانیوم با بافت سخت نه تنها به وسیله مقاومت در برابر خوردگی عالی، بلکه به وسیله عوامل دیگر نیز ایجاد می شود.
همانطور که در بالا توضیح داده شد، ترکیب فیلم اکسید سطحی براساس تغییر در محیط به رغم پایداری ماکروسکوپی متفاوت است. ترکیب و خواص فیلم اکسیدی بازسازی شده در محیط بیولوژیکی با آب موجود متفاوت است ]38[. همانطور که در بالا ذکر شد، تیتانیوم به طور طبیعی کلسیم فسفات را روی خودش ایجاد می کند. بنابراین، تشکیل استخوان روی تیتانیوم ایمپلنت شده در بافت سخت واقعاً سریعتر است، زیرا فیلم اکسید سطحی، اکسید تیتانیوم است.
جذب پروتئین بر چسبندگی سلولها تأثیر می گذارد. سطح تیتانیوم تقریباً متوسط است و بار کاملاً مثبت یا منفی را نشان نمی دهد. بنابراین، تأثیر پروتئین هایی که به تیتانیوم جذب می شوند نسبت به سایر فلزات کمتر است. علاوه بر این، پروتئین ها با کمی تغییر شکل در سطح تیتانیوم جذب می شوند، بنابراین خاصیت پروتئین بعد از جذب باقی می ماند.
همانطور که در بالا توضیح داده شد، بسیاری از محققان با مشخص کردن اکسید سطحی تیتانیوم (ترکیب و تغییر آن)، گروه های هیدروکسیل سطحی، جذب پروتئین ها (مقدار، سرعت، تغییر در ترکیب و دناتوراسیون)، چسبندگی، تکثیر و تمایز سلولها سعی در توضیح مکانیزم فرآیند پیوند استخوانی دارند. با این حال، مکانیزم واقعی پیوند استخوانی هنوز مشخص نیست.
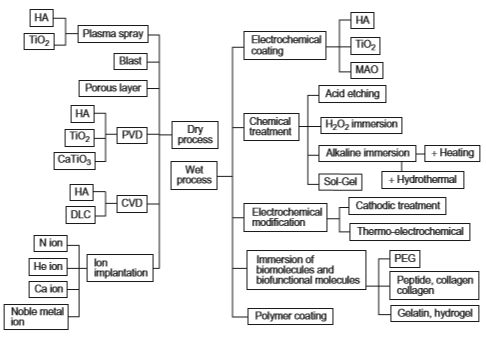
شکل 2-1-8 روش های اصلاح سطح مورد مطاالعه در زمینه بیومواد که برخی از آنها تجاری شده اند
2-1-3 روشهای اصلاح سطح
2-1-3-1 مرور کلی
برای بهبود زیست سازگاری و افزودن عملکرد زیستی همانطور که قبلاً توضیح داده شد، اصلاح سطح ضروری است. از طرف دیگر، سطوح متخلخل یا چقرمه شده معمولاً روی اتصال بافت استخوان به مواد تیتانیومی تأثیر می گذارد. انتظار می رود که بافت استخوانی انسان در سطح چقرمه و متخلخل رشد کند؛ تا مواد و استخوان به عنوان نتیجه حاصل از اثر لنگر زدن به همدیگر متصل شوند. شکل 2-1-3 پیوند شیمیایی و اتصال لنگر مکانیکی بین استخوان و ماده را نشان می دهد. روشهای اصلاح سطح فعلی برای بهبود تمرکز سازگاری با بافت سخت در اثر اتصال شیمیایی و یا لنگر مکانیکی به زیرلایه فلزی می باشد. روشهای اصلاح سطح مورد مطالعه در زمینه مواد بیولوژیکی در شکل 2-1-8 خلاصه شده و برخی از اینها قبلاًٌ تجاری شده اند. روشهای اصلاح سطح در بخش های دیگر ارزیابی می شوند ]39-41[.
2-1-3-2 دسته بندی اصلاح سطح
با توجه به هدف اصلاح سطح (به جدول 2-1-1 نگاه کنید)، مناسب ترین روش اصلاح باید انتخاب شود. روشهای اصلاح سطح به شرح زیر دسته بندی می شوند.
2-1-3-2-1 فرآیند تر و خشک
فرآیندهای خشک (در هوا، کاهش فشار و خلأ انجام شده) و فرآیندهای تر (در محلولهای آبی انجام شده) قراردادی هستند. بلاست و زینترینگ مهره، فرآیندهای مکانیکی برای ایجاد سطوح خشن هستند. فرآیند خشک را می توان با توجه به اثرات روی سطح جامد طبقه بندی کرد: تشکیل فیلم، پاشش و کاشت یونی. وقتی یونی به سطح جامد برخورد می کند، با توجه به انرژی یونی، چسبندگی، پاشش و اثرات کاشت روی سطح اتفاق می افتد. پاشش روشی مفید برای تشکیل لایه خشن TiO2 و لایه های هیدروکسی آپاتیت (HA) است. این روشها با موفقیت تجاری سازی شده اند. همچنین، PVD و CVD روش های مفیدی برای تشکیل لایه های نازک و صاف می باشند. از طرف دیگر، کاشت یونی برای تشکیل لایه تعادل گرمایی استفاده می شود. این لایه اصلاح شده سطح، گاهی اوقات در تسریع تشکیل استخوان مؤثر می باشد ]42[. اشکال این فرآیند قیمت بالای تجهیزات موردنیاز است. بنابراین، فرآیند خشک برای تولید انبوه مناسب می باشد.
فرآیند تر در محلولهای آبی انجام می شود. این فرآیند نیازی به امکانات بزرگ یا هزینه های بالا ندارد. در فرایند تر، اصلاحات در محلول های آبی با فرآیندهای غوطه وری و الکتروشیمیایی انجام می شود. فرآیند تر به ابزارهای خاصی نیاز ندارد و به سادگی در سطح آزمایشگاهی قابل انجام است. لایه اصلاح شده حاصل با توجه به تغییر پارامترهای زیر تغییر می کند:
-
ترکیب و pH محلول آبی.
-
افزایش بالقوه حاصل از الکترولیز.
-
چگالی جریان الکترولیز.
در اسید اچ، می توان یک سطح خشن به دست آورد. غوطه وری در محلول قلیایی روی تسریع تشکیل استخوان مؤثر بوده؛ و تجاری نیز شده است ]43[. روشهای الکتروشیمیایی مانند اکسیداسیون آندی، قطبش کاتدی و عدم تحرک مولکولهای دو عاملی بعداً توضیح داده می شوند.
2-1-3-2-2 لایه سطحی
از نظر ضخامت حاصل و ترکیب لایه سطحی، روشهای اصلاح سطح به سه دسته طبقه بندی می شوند: پوشش لایه نازک، تشکیل لایه اصلاح شده سطحی و عدم تحرک مولکولهای دو عاملی (شکل 2-1-9). پوشش لایه نازک یک روش و یک قرارداد برای روش اصلاح سطح است. لایه های ترکیب نازک و یکنواخت معمولاً با ضخامت چند میکرومتر به وسیله پاشش پلاسما، PVD، CVD، اکسیداسیون آندی و ... تشکیل می شوند. تشکیل لایه اصلاح شده سطح با کاشت یونی، عملیات قلیایی ]43[ و قطبش کاتدی انجام می شود. عدم تحرک مولکولهای دو عاملی نیز با عملیات شیمیایی و رسوب دهی الکتریکی انجام می شود.
شکل 2-1-9 طبقه بندی با توجه به ضخامت حاصل و ترکیب لایه سطحی: پوشش لایه نازک، تشکیل لایه اصلاح سطح و عدم تحرک مولکولهای دو عاملی
2-1-3-2-3 تشکیل کلسیم فسفات
برای تسریع در تشکیل استخوان، محبوبترین روش، پوشش کلسیم فسفات مانند HA است. پاشش پلاسمای آپاتیت بر روی فلزات به طور گسترده برای تشکیل لایه آپاتیت استفاده می شود، که این لایه هسته ای برای تشکیل استخوان فعال و رساننده است. با این حال، در مورد HA که پاشش پلاسمایی شده، احتمال شکستن رابط HA-تیتانیوم یا خود HA تحت تنش نسبتاً کم وجود دارد، زیرا استحکام چسبندگی و چقرمگی لایه HA اسپری شده کم می باشد ]44[. باید از روشهای دیگری برای بهبود چقرمگی و چسبندگی لایه HA استفاده کرد. از طرف دیگر، سازگاری با بافت سخت را می توان با تغییر سطح تیتانیوم به جای پوششدهی با لایه HA بهبود بخشید. در نتیجه، روشهای مختلف تغییر سطح تیتانیوم به شرح زیر است:
-
غوطه وری در محلول قلیایی و حرارت دهی.
-
غوطه وری در محلول هیدروژن پراکسید.
-
غوطه وری و عملیات هیدروترمال در محلول حاوی کلسیم.
-
کاشت یون کلسیم.
معروف ترین روش، عملیات قلیایی است. با غوطه وری تیتانیوم در محلولهای قلیایی NaOH و KOH، یک ژل اکسید تیتانیوم هیدراته شده حاوی یون های قلیایی با ضخامت 1 میکرومتر روی زیرلایه تیتانیوم تشکیل می شود ]43[. پس از حرارت دهی، لایه ژل متراکم شده و سپس به شدت به زیرلایه می چسبد.
2-1-3-2-4 لنگر و پیوند شیمیایی
روش های اصلاح سطح فعلی برای بهبود سازگاری با بافت سخت متمرکز بر تقویت پیوند شیمیایی و یا افزایش لنگر مکانیکی است، همانطور که قبلاً توضیح داده شد. چقرمگی سطح معمولاً توسط فرآیند اصلاح سطح تغییر می کند. حتی هدف قرار دادن پیوند شیمیایی، مورفولوژی سطح را همیشه تغییر می دهد؛ گاهی اوقات لنگر مکانیکی نیز به عنوان یک عامل تأثیرگذار وجود دارد (شکل 2-1-10). بنابراین، تشخیص اثر شیمیایی و لنگر هنگام انجام اصلاح سطح دشوار است.
2-1-3-2-5 چسبندگی سلول
مطابق با هدف اصلاح سطح، چسبندگی سلول همانطور که در شکل 2-1-11 نشان داده شده یا ضروری یا غیرضروری است. برای تسریع تشکیل استخوان، پیوند استخوان و چسبندگی بافت نرم باید سلولها به صورت پایدار به هم بچسبند، تفکیک شوند و به سرعت بافت ها را ایجاد کنند. از طرف دیگر برای جلوگیری از چسبندگی باکتریها، تشکیل بیوفیلم، چسبندگی پلاکتها و تشکیل ترومبوز باید مانع از چسبندگی سلول شد. بنابراین، این خواص از نظر چسبندگی سلول کاملاً مخالف هم هستند.
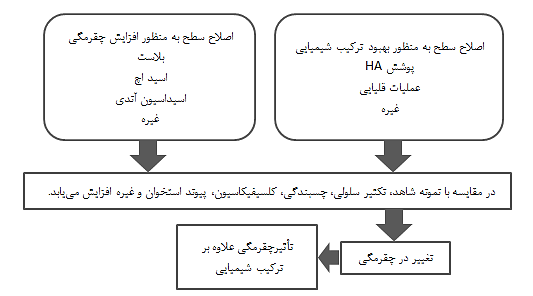
شکل 2-1-10 تغییر در چقرمگی سطح به منظور بهبود ترکیب سطحی حتی با اصلاح سطح
2-1-3-3 روش های رسوب دهی الکتریکی و الکتروشیمیایی
رسوب دهی الکتریکی به سه فرآیند زیر تقسیم می شود: (1) آبکاری، (2) رسوب الکتروفورزی و (3) رسوب منطقه پایین پتانسیل. برای مواد بیوزیستی، سرامیک ها و پلیمرها روی مواد فلزی رسوب دهی الکتریکی می شوند. زیرلایه های هدف برای رسوب دهی الکتریکی تیتانیوم و آلیاژهای آن حاوی آلیاژ نیکل تیتانیوم سوپرالاستیک و آلیاژ حافظه دار میباشد؛ مواد پوشش برای رسوب دهی الکتریکی، سرامیک هایی مانند HA، اکتاکلسیم فسفات (OCP)، براشیت (DCPD)، سایر کلسیم فسفاتها (Ca-P)، DLC و TiO2، فلزاتی مانند منیزیم و تانتالیوم و پلیمرهایی مانند کلاژن، کیتوسان و پلی (اتیلن گلیکول) (PEG) هستند. ترکیبات بین زیرلایه های هدف و مواد پوشش، رسوب دهی الکتریکی شده و اهداف موردنظر در زمینه رسوب دهی الکتریکی در جدول 2-1-2 خلاصه شده است. این ترکیبات با توجه به هدف مواد حاصل تغییر می کنند. پوشش HA معمولاً به منظور بهبود سازگاری با بافت سخت (تشکیل استخوان و پیوند استخوان) انجام می شود. پوشش DLC برای بهبود سایش اصطکاکی انجام می شود. پوشش TiO2 برای بهبود مقاومت در برابر خوردگی و سازگاری با بافت سخت بخصوص پیوند استخوان با تشکیل لایه های متخلخل هم بند انجام می شود. لایه ضخیم TiO2 با منافذ هم بند به وسیله اکسیداسیون ریزقوسی (MAO) ساخته می شود.
بیومولکول و مولکولهای دو عاملی نسبت به سطح فلز حرکتی ندارند تا عملکردهای زیستی را نیز به فلز اضافه کنند. رسوب دهی الکتریکی در تیتانیوم و آلیاژهای آن در شکل 2-1-12 نشان داده شده است. مطالعات درمورد فرآیند رسوب دهی الکتریکی مواد بیوزیستی در بخشهای دیگر مرور شده است ]45[.
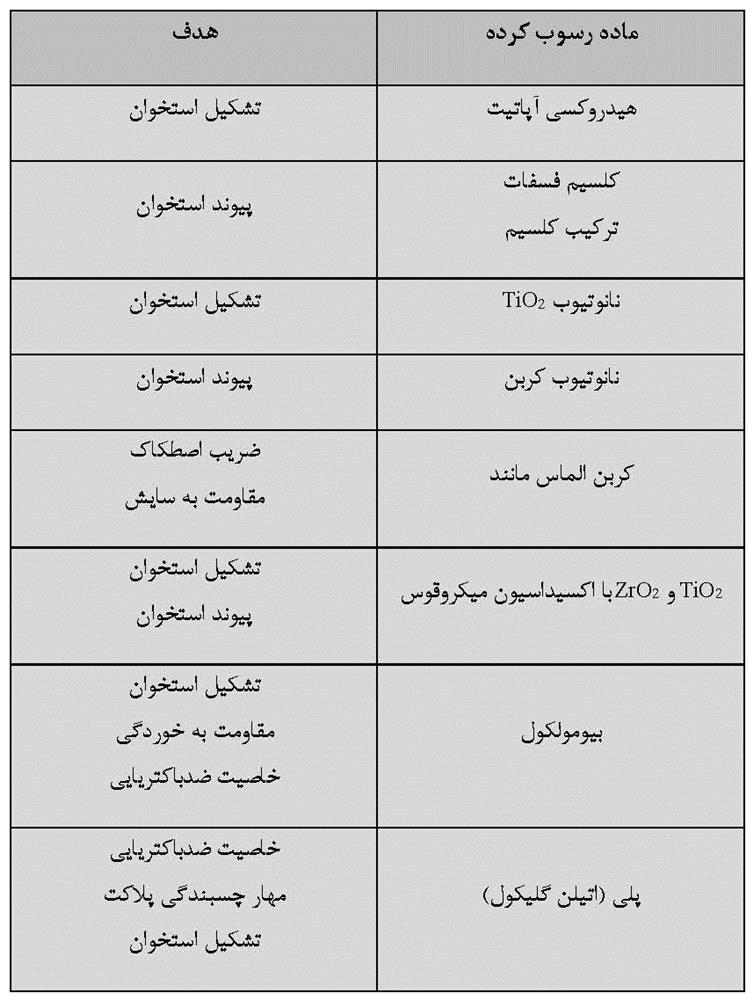
جدول 2-1-2 لایه های رسوبدهی شده الکتریکی با تیتانیوم و آلیاژهای آن و هدف
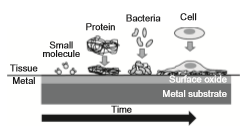
شکل 2-1-11 چسبندگی بافت سلولی و باکتریایی پس از جذب پروتئین به سطح فلز
2-1-3-4 عدم تحرک مولکولهای دو عاملی
عدم تحرک مولکولهای دو عاملی نسبت به سطوح فلزی مؤثر است تا عملکردهای بیولوژیکی نیز به فلز اضافه شود. سازگاری با بافت سخت و سازگاری با بافت نرم فلزات، گاهی اوقات مانند زمانی که فلزات برای اجزای ایمپلنت استفاده می شوند، الزامی است. استنت ها برای اتساع تنگی رگهای خونی قرار می گیرند و همچنین برای سازگاری با خون نیز الزامی است. علاوه بر این، گاید وایرها و کانترها برای لغزش مناسب به روانکاری در رگهای خونی نیاز دارند. هنگامی که فلزات به عنوان دستگاه های نمونه برداری استفاده می شوند، باید چسبندگی سلولها را کنترل کرد. علت اصلی بازیابی ایمپلنت ها در طی خدمات، عفونت ناشی از تشکیل بیوفیلم می باشد. بنابراین، یک سطح مهارکننده بیوفیلم لازم است؛ که خاصیت اصلی آن کنترل جذب پروتئینها و چسبندگی سلولها، پلاکت ها و باکتری ها می باشد. این سطح عملکردی احتمالاً با عدم حرکت مولکولهای دو عاملی ایجاد شود. این روش امکان استفاده از فلزات را به صورت یک چهارچوب در رشته پزشکی ترمیمی فراهم می کند. برخی از کامپوزیت های پلیمر- فلزی در سایر کتابهای درسی مورد بررسی قرار گرفته است ]46-48[.
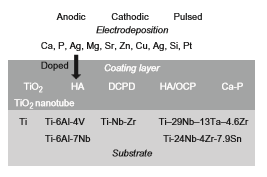
شکل 2-1-12 خلاصه گرافیکی لایه پوشش که توسط رسوب دهی الکتریکی تشکیل شده است
2-1-4 گذرا به وسیله اصلاح سطح
با مراجعه به ساقه مفاصل هیپ مصنوعی و تجهیزات ایمپلنت های دندانی، زمان گذرا به وسیله روشهای اصلاح سطح برای بهبود تشکیل استخوان و پیوند استخوان را می توان در سطح پژوهش و سطح تجاری در شکل 2-1-13 مشاهده کرد.
-
نسل اول: سطح ماشینکاری
-
نسل دوم: سطح مورفولوژیکی
-
نسل سوم: سطح فعال فیزیکی-شیمیایی
-
نسل چهارم: سطح فعال بیوشیمیایی
-
نسل پنجم: سطح بیولوژیکی؟
تغییرات سطح در نسل چهارم توسط محققان به راحتی پذیرفته شد، زیرا عدم تحرک بیومولکولها به منظور تسریع تشکیل استخوان به راحتی قابل درک است. بنابراین، تحقیقات زیادی انجام شده است. با این حال، برای تجاری سازی عدم تحرک مولکولهای دو عاملی، ایمنی، حفظ کیفیت در حین ذخیره سازی و دوام لایه تحرک مشروط به خشک ضروری است. این امر برای تولیدکنندگان دشوار است مگر اینکه ارزش تجاری سازی را پیدا کنند. برای تجاریسازی مواد بدون حرکت مشکلات زیادی وجود دارد، در حالیکه نتایج خوبی را در تحقیقات اساسی نشان می دهد.
در نهایت، اکثر کالاهای تجاری شده به دو دسته طبقه بندی می شوند. چندین کالای تجاری از نسل سوم وجود دارد، اما در حال حاضر هیچ چشم اندازی برای تجاری سازی نسل چهارم وجود ندارد. این عدم تطابق بین تحقیقات و تجاری سازی همیشه ناشی از تأخیر در مجوز تجاری سازی نیست. دلیل دیگر تأخیر در تجاری سازی کالاهای نسل سوم احتمالاً کالاهایی هستند که از لنگر مکانیکی با سطح خشن استفاده می کنند و انتظار رویش درونی استخوان با سطح متخلخل را دارند؛ این کالاها عملاً بهتر از کالاهایی هستند که از پیوند شیمیایی با استخوان استفاده می کنند.
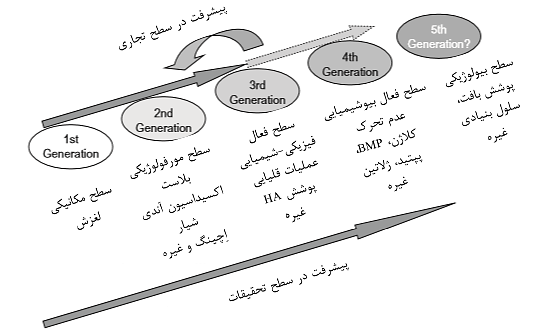
شکل 2-1-13 زمان گذرا از روشهای اصلاح سطح به منظور تسریع تشکیل استخوان و بیگانگی
در روشهای اصلاح سطح بین حالت تحقیقاتی و تجاری سازی
2-1-5 کاربرد پزشکی ترمیمی
تیتانیوم به طور گسترده در ایمپلنت های پزشکی مورد استفاده قرار می گیرد و ممکن است سطوح آنها از طریق روشهای مختلفی مانند: فرآیندهای خشک و تر حاوی عدم تحرک بیومولکولها عملکرد زیستی پیدا کنند. هدف اصلی اصلاح سطح، بهبود سازگاری با بافت سخت یا تسریع در تشکیل استخوان است. از طرف دیگر، رسوب دهی الکتریکی برای همه مواد الکترورسانا و مورفولوژیکی نه تنها به منظور مهار چسبندگی پلاکت و چسبندگی باکتری بلکه برای تقویت تشکیل استخوان نیز مفید است. این روشها امکان استفاده از فلزات را به صورت چهارچوب در رشته پزشکی ترمیمی فراهم می کنند. احتمالاً امکان استفاده از روشهای نسل چهارم برای انجام اصلاح سطح نسل پنجم وجود داشته باشد. همچنین برای چهارچوب ها، فیبر تیتانیوم، فویل و مش مفید هستند.
2-1-6 آینده ی روشهای اصلاح سطح
فلزات به طور گسترده و ایمن علاوه بر ایمپلنت های ارتوپدی، برای دستگاههای قلبی- عروقی و اهداف دیگر نیز مورد استفاده قرار می گیرند. دستگاه های ایمپلنت همیشه در تماس با بافت های زنده استفاده می شوند. بنابراین، تعامل بین سطوح ماده و بافت های زنده باید به خوبی درک شود. این دانش برای توسعه مواد جدید الزامی است؛ بخصوص واکنش هایی که بین بیومولکولها یا بین سلولها و سطوح فلزی هستند، بسیار اهمیت دارد. دانش عالی درباره این واکنش ها همیشه به اضافه کردن عملکردهای زیستی به فلزات کمک می کند. اگر هر دو خواص ضد باکتریایی و تشکیل استخوان یا هر دو خواص ضدباکتریایی و چسبندگی بافت نرم به طور همزمان به دست آیند، این ماده به عنوان یک ماده چند منظوره مرزی و بهینه شناخته می شود. علاوه بر این، تابع حساس با روش اصلاح سطح می تواند به سطح تیتانیوم اضافه شود.
پایان فصل